文章信息
- 沈慧颖, 吕子豪, 庄粟裕, 曹秀明, 王清清
- SHEN Hui-ying, LYU Zi-hao, ZHUANG Su-yu, CAO Xiu-ming, WANG Qing-qing
- 静电纺CA/PpIX多孔纤维膜的制备及其光动力性能
- Preparation and photodynamic performance of electrospinning CA/PpIX porous fibrous membrane
- 材料工程, 2021, 49(5): 89-97
- Journal of Materials Engineering, 2021, 49(5): 89-97.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2020.000495
-
文章历史
- 收稿日期: 2020-06-01
- 修订日期: 2020-09-17
2. 江苏阳光股份有限公司, 江苏 无锡 214400
2. Jiangsu Sunshine Co., Ltd., Wuxi 214400, Jiangsu, China
近年来,抗生素在全球范围的过度使用或滥用导致了具有多重耐药性的“超级细菌”的出现和传播,预防病原体感染已成为一个重要的医学和社会问题,发展新型抗菌策略迫在眉睫[1-2]。光动力抗菌化学疗法(photodynamic antimicrobial chemotherapy,PACT)就是一种用于预防微生物感染十分有前景的新型疗法,可以用于包括细菌、病毒以及真菌在内的多种微生物的灭活[3]。与传统抗菌方法相比,该疗法具有广谱抗菌的特点,且不会导致细菌产生抗性,生物毒性低[4],具有良好的研究前景。PACT法的原理是光敏剂受光激发后,将能量传递给氧分子,使其生成具有细胞毒性的单线态氧(singlet oxygen,1O2)等活性氧物质(reactive oxygen species,ROS)来使微生物失活,化学机理包括Ⅰ型机制(自由基机制)和Ⅱ型机制(单线态氧机制)[5-6]。
血卟啉是仅有的几种被批准应用于临床治疗且已商品化的光敏药物,其前体5-氨基酮戊酸(5-ALA)本身不具备光敏活性,但是它产生的内源性原卟啉(PpIX)却具备极强的光敏活性,其毒性低、代谢快,避光1~2天便可快速从机体内清除,是很好的光动力药物,商品化和临床应用前景十分乐观[7-8]。光敏剂在固体材料上的固定为其使用提供了便利且性能良好的光敏剂载体对光动力效应具有促进作用。静电纺丝由于其良好的可操控性,为光敏抗菌型纤维的应用提供了无限的可能。作为再生纤维素纤维,二醋酸纤维(CA)具有良好的生物相容性与生物降解性,而且其相对分子质量小,易于实现表面造孔[9]。静电纺多孔醋酸纤维,在保留醋酸纤维素原有性质的基础上,还可获得静电纺多孔纤维特有的超细直径、高孔隙率和高比表面积等特点[10],故将原卟啉PpIX负载于静电纺CA膜上具有良好的研究意义。但是,作为中性光敏剂,PpIX对革兰氏阴性菌的光敏抗菌效果十分有限,其原因在于单线态氧的扩散距离很短[11],光敏剂分子不易与带负电荷的革兰氏阴性菌外膜紧密结合,除非采用外膜渗透[12]的方法,例如与多粘菌素九肽[13]或者乙二胺四乙酸(EDTA)结合[14]。此外,还有研究将光敏剂与简单无毒的KI[15-16], NaN3[17]等无机来制备负载不同比例原卟啉(0, 5%, 10%, 质量分数,下同)的多孔醋酸纤维膜(CA/PpIX),并对所得纤维膜的形态、PpIX分布盐溶液相结合来改善光动力抗菌效果。无机盐的加入可以将传统光敏剂PS转化为强力抗菌PS,明显增强光敏抗菌效果,提高对革兰氏阴性菌(以及革兰氏阳性菌和真菌)的抗菌效果。
针对细菌耐药问题,本工作采用静电纺丝法制备醋酸/原卟啉(CA/PpIX)复合多孔超细纤维膜,对纤维膜的形貌、光敏剂的分布、化学结构以及底物氧化性能进行了研究,并且评价了材料对金黄色葡萄球菌及大肠杆菌的光敏抗菌效果。最后,设计3种(KI,NaNO2,MgCl2)无机盐溶液浓度梯度实验,探究不同种类无机盐溶液对CA/PpIX膜光敏抗菌效果的增强作用。
1 实验材料与方法 1.1 实验材料二醋酸纤维素(CDA,MW = 200000,特性黏度Iv=1.45 dL /g)购自南通醋酸纤维有限公司;丙酮,分析纯;二氯甲烷(DCM),分析纯;碘化钾,分析纯;氯化镁,分析纯;亚硝酸钠,分析纯,均购自国药集团化学试剂有限公司;原卟啉(PpIX),纯度≥99.99%,优级纯;1,3-二苯基异苯并二吡喃(DPBF),纯度> 98%以及重水(D2O)购自上海维塔化学试剂有限公司;金黄色葡萄球菌(ATCC-6538)及大肠杆菌(8099),购自上海协久生物科技有限公司。
1.2 静电纺多孔CA/PpIX复合纤维的制备将1.014 g醋片溶于50 mL装有20 mL DCM/丙酮(体积比为8/2)混合溶液的锥形瓶中,配制成质量分数为4%的二醋酸纤维纺丝液,随后置于磁力搅拌器上常温搅拌6 h以上以形成均质溶液。同时制备3个上述纺丝液,待混合溶液搅拌均匀后,取其中两个锥形瓶中分别加入质量为50.7, 101.4 mg的PpIX,避光,接着置于磁力搅拌器上常温搅拌24 h以上至溶质完全溶解,另一个锥形瓶不添加PpIX,从而得到CA为4%,PpIX为CA的0, 5%, 10%的纺丝液。
将配置的上述3种纺丝液倒入规格为20 mL且表面包覆锡纸的注射器中,安装到微量注射泵上,在注射器针头(外径0.7 mm)接上高压电源的正极,用覆有光滑铝箔纸的滚筒作为接收装置与负极相连。在高压静电场作用下,纺丝液所受电场力克服溶液表面张力后,喷射出带电射流,随着溶剂的挥发,固化为纤维随机排布于收集装置上[18]。静电纺丝工艺参数为:室温,避光,纺丝电压19 kV,注射泵控制溶液流速2 mL/h,纺丝接收距离15 cm,滚筒的转速600 r/min。分别纺得CA, CA/PpIX-5, CA/ PpIX-10纤维膜,纺丝结束后,卸下铝箔纸,置于65 ℃的真空烘箱中干燥6~12 h备用。
1.3 复合纤维膜的单线态氧直接检测使用FL3-111 Horiba稳态瞬态荧光光谱仪检测CA/PpIX膜光照条件下产生的单线态氧(1O2)。将3 cm×3 cm的CA/PpIX膜浸入装有1.5 mL D2O的10 mL烧杯中,使用D2O的原因在于1O2在D2O (≈67 μs)中的寿命比在H2O (≈3.5 μs)中的更长,从而使磷光检测更容易[11]。随后,用LED灯(6 W)光照10 min,将溶液转移到0.7 mL的石英比色皿中。最后,以氙灯(450 W)为激发源进行单线态氧检测,激发波长为405 nm,带通为8 nm,检测到1O2的荧光发射,发射波长范围1100~1400 nm,带通为20 nm。
1.4 复合纤维膜的氧化性能通过底物DPBF/甲醇溶液在光照条件下410 nm处的吸光度变化来判断复合纤维膜的氧化能力。将CA,CA/PpIX-5,CA/PpIX-10纤维膜置于温度为60 ℃的干燥箱中烘燥3 h并用直径为1.4 cm的压片机将其切成圆形。将圆形薄膜分别置于10 mL的装有5 mL 74 μM DPBF/甲醇溶液的烧杯中,在激光笔(λ=532 nm,40 mW)的照射下,每隔1.5 min用UV-2600型紫外分光光度计记录一次溶液的光谱及特征波长下(410 nm)的吸光度,并与相应的暗室样品进行对照。
1.5 光动力抗菌性能评价参考AATCC 100-2012《抗菌纺织品的评价方法》对CA, CA/PpIX-5, CA/PpIX-10纤维膜进行抗菌性能评价,选取革兰氏阳性菌中的金黄色葡萄球菌(S. aureus)和革兰氏阴性菌中的大肠杆菌(E. coli)两种菌作为测试菌种。
将真空干燥后的纤维膜裁成若干个大小形状一致、厚度均一的圆形试样,并将其分别放入24孔板中。取0.1 mL浓度为1×108~3×108 cfu/mL的菌液(PBS缓冲液)滴在24孔板中的样品上,并将各组样品分别置于光照(光强为65 mW/cm2,波长为420~780 nm)及暗室条件中培养30 min后,加入0.9 mL的PBS缓冲液。振荡均匀后,分别取0.1 mL的原菌液(空白对照组)以及与试样上的菌液,加入0.9 mL PBS缓冲液,在3 mL的离心管中依次等梯度稀释106倍(每个样品做3组平行实验)。最后分别从每个离心管中取10 μL各稀释梯度的溶液滴在TSA(S. aureus)或LA(E. coli)培养基平板上,放置于37 ℃恒温培养箱中培养。培养24 h后记录平板各列的菌落数,以与其等浓度的原菌液(没有样品膜的24孔板)为对照组计算细菌存活率与标准差,根据式(1)可以计算出抑菌率N,对CA, CA/PpIX-5, CA/PpIX-10纤维膜的抗菌效果进行评价。
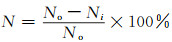
|
(1) |
式中:No为原菌液可计数列的菌落最大值;Ni为试样抗菌后与原菌液对应梯度下的菌落值。
1.6 KI及无机盐促进CA/PpIX膜光动力抗菌性能评价与上述纯纤维膜抗菌步骤操作不同的是,在探究不同浓度梯度的无机盐溶液(0,10,25,50,100 mmol/L)对CA/PpIX-5, CA/PpIX-10膜介导的光动力抗菌效果增强实验时,需分别在24孔板中的纤维膜上滴加100 μL的无机盐溶液(KI或MgCl2或NaNO2)和100 μL含有107~108cfu/mL细菌的PBS溶液后摇匀,然后在氙灯下(光强为65 mW/cm2,波长为420~780 nm)光照30 min,同时对照组置于暗室30 min。光照结束后各加入0.8 mL PBS缓冲液进行稀释,随后的操作与上述抗菌方法相同。除此之外,仅含有纯无机盐溶液及加入CA纤维膜无机盐溶液的24孔板也需进行相同条件的光照以作为光照组对照组。
1.7 其他表征用SU1510型扫描电子显微镜观察CA, CA/PpIX-5, CA/PpIX-10纤维膜的表面形貌;用TCS SP8型激光共聚焦扫描显微镜观察PpIX在静电纺多孔醋酸纤维上的分布情况(PpIX的荧光激发波长为405 nm,发射波长为632 nm);用Nicolet IS10型傅里叶变换红外光谱仪中的衰减全反射红外光谱法(ATR-FTIR)对纤维膜进行测试分析(分辨率为4 cm-1,扫描次数为16次,波数范围为4000~800 cm-1);用LABRAM HR-800型拉曼光谱仪进一步对PpIX粉末和纤维膜进行表征,判断PpIX的负载情况(激发波长为514 nm,波数范围1750~900 nm)。
2 结果与讨论 2.1 形貌观察图 1是纯CA膜、CA/PpIX-5以及CA/PpIX-10多孔醋酸纤维膜的扫描电镜图和激光共聚焦扫描显微镜图。

|
图 1 CA(a),CA/PpIX-5(b)和CA/PpIX-10(c)纤维膜的SEM图像与CLSM图像 (1)SEM图; (2)CLSM重叠图; (3)CLSM荧光图像 Fig. 1 SEM images and CLSM images of CA (a), CA/PpIX-5 (b), CA/PpIX-10 (c) fibrous membrane (1)SEM images; (2)CLSM overlapping images; (3)CLSM fluorescence images |
从图 1(a-1),(b-1),(c-1)来看,负载原卟啉后的多孔醋酸纤维形貌并没有发生显著的改变。与传统静电纺醋酸纳米纤维相比(纤维表面光滑、无孔,直径约为500 nm[19]),多孔醋酸纤维的直径更粗,为微米级(通过粒径分布计算软件测得平均直径在2~3 μm)。这可能是由二氯甲烷快速挥发使得射流快速凝固,纤维未能得到足够的牵伸而导致的[19]。从图 1的SEM照片中可以发现,纤维大多为多孔柱状,含有少量的扁平带状,这是因为射流在拉伸固化时,溶剂的快速挥发使得射流表层先形成多孔结构,而射流内层的溶液形成浓度梯度差,同时表面溶剂的挥发速率远大于内层溶剂的扩散速率,从而在大气压作用下坍塌形成扁平带状结构[20]。此外,沿纤维轴向分布的孔洞清晰可见且分布较为均匀,多为细长椭圆形,其大小深浅不一。孔洞的形成是由于DCM(沸点39.8 ℃)的高挥发性,其在静电纺丝过程中快速挥发,使得射流表面温度急剧降低,引发热致相分离,形成富溶质相和富溶剂相;此外温度的下降使周围环境中的水蒸气液化为小水珠聚集在射流表面,CA和PpIX均不溶于水,聚合物在水珠周围凝固。在两者的共同作用下,富溶质相处形成纤维骨架,富溶剂相和水珠在纺丝过程中快速挥发,在纤维表面形成凹凸不平、大小不一的孔洞[19]。表面多孔的CA/PpIX纤维膜对细菌有良好的吸附效果,可使活性氧物种与细菌膜结构有效接触,从而更好地发挥抗菌效果。
从图 1(a-3)可以观察到,未添加原卟啉的纯CA膜没有表现出任何荧光效应。而CA/PpIX-5和CA/PpIX-10纤维膜则发出均匀的红光,图 1(b-3),(c-3),表明PpIX均匀地分布在多孔醋酸纤维表面上,并未完全包埋在纤维内部,实现了良好的表面负载。虽然光敏剂含量CA/PpIX-5比CA/PpIX-10少50%,但从荧光效应图上发现两者的表面负载量相差不大。可能是因为射流表层溶剂挥发的同时使得表层溶液的浓度随之升高,而PpIX在浓度较高时极易发生聚集现象[21],因此在射流表面发生了一定程度的聚集,而光可能无法穿透某些聚集体的内部,故只有表层的PpIX在激发波长下发出荧光。
2.2 化学结构分析图 2为纯CA,CA/PpIX-5,CA/PpIX-10纤维膜的红外光谱图以及共振拉曼光谱。
|
图 2 CA,CA/PpIX-5,CA/PpIX-10纤维膜的ATR-FTIR光谱(a)和拉曼光谱(b) Fig. 2 ATR-FTIR spectra (a) and Raman spectra (b) of CA, CA/PpIX-5 and CA/PpIX-10 fibrous membranes |
如图 2(a)红外光谱所示,对于纯CA膜来说,其特征峰在1740,1040,1370 cm-1处分别对应C=O, C—O—C的伸缩振动以及C—CH3的对称弯曲振动[22]。在CA/PpIX-5及CA/PpIX-10的红外光谱图中,峰的位置及强度大体上相同,其具备纯CA膜所有的特征峰。此外,1430 cm-1为吡咯环上的C—N伸缩振动峰,其与—CH3的非对称弯曲振动峰在此处重合;1225 cm-1处为C—O的伸缩振动峰,又为卟啉环内振动,可以明显地看出,在此波数下,CA/PpIX的峰强要高于CA。而且,与纯CA膜相比,在835 cm-1处出现了一个新的吸收峰,为卟啉环外振动(吡咯环上的N—H向外弯曲振动)[23]。
由于PpIX分子具有对称结构,故可用共振拉曼光谱进一步表征PpIX在CA膜上负载。从图 2(b)中可以看出,纯PpIX粉末在1590,1545,1330 nm处有3个明显的特征峰,其分别对应卟啉大环分子上的C=N双键、乙烯基(C=C)和吡咯环[22];纯CA膜,在波长900~1750 nm之间没有表现出任何特征峰。而CA/PpIX-5及CA/PpIX-10纤维膜表现出与PpIX粉末相同的特征峰,且由于后者光敏剂负载量高,故其峰强度明显高于前者。以上结果均可以表明,PpIX成功负载到了醋酸纤维表面。
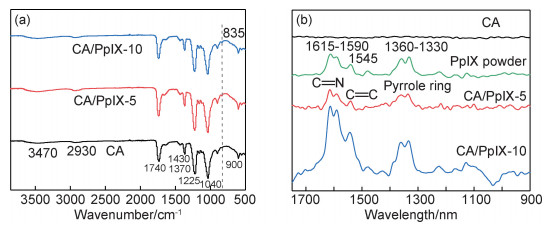
2.3 单线态氧的直接检测及底物氧化图 3是CA, CA/PpIX膜的瞬态荧光光谱及DPBF溶液紫外吸收光谱。原卟啉PpIX经光照后可产生在单线态氧(1O2),当1O2回到基态时,可辐射能量发光。利用瞬态光谱技术可以观察到单线态氧在1270 nm发光[6]。图 3(a)是CA及CA/PpIX膜的瞬态荧光光谱,1270 nm处出现特征峰证明CA/PpIX在光照条件下确实产生了1O2[24]。
|
图 3 CA,CA/PpIX纤维膜的瞬态荧光光谱(a)、CA/PpIX-10膜的DPBF溶液紫外吸收光谱(b)和410 nm处不同质量分数CA/PpIX膜的DPBF溶液紫外吸收曲线(c)以及对照组(d)的DPBF溶液紫外吸收曲线 Fig. 3 Transient state fluorescence spectrum (a), UV-Vis absorption spectra of KI solution photooxidized by CA/PpIX-10 (b), UV-Vis absorbance of DPBF solution at 410 nm photooxidized by different proportions of CA/PpIX membranes (c) and control group (d) |
DPBF是一种荧光分子,对单线态氧(1O2)具有高度特异性反应,它可以与1O2发生Diels-Alder型加成反应生成内过氧化物,将其氧化成二苯甲酰基苯(BPO)[25],使DPBF荧光强度降低。图 3(b)是CA/PpIX-10纤维膜在持续光照条件下,溶液紫外吸收变化的光谱图。在1O2的氧化作用下,随着光照时间的延长,荧光色的DPBF逐渐被氧化成无色的BPO,溶液颜色逐渐变浅,在410 nm处的吸光度随之下降。图 3(c),(d)是纯CA膜、CA/PpIX-5以及CA/PpIX-10纤维膜410 nm处吸光度随时间的变化图。经激光照射后,纯CA膜和DPBF没有发生氧化反应,溶液410 nm处的吸光度几乎没有变化,而CA/PpIX-5及CA/PpIX-10纤维膜的吸光度显著下降,且随时间成线性变化,说明其具有良好的光动力氧化性能。然而,尽管CA/PpIX-10负载了更多的光敏剂,但其光敏活性在一定程度上受到PpIX团聚的影响,故其有效负载量较低[21],单线态氧产率较CA/PpIX-5稍低。另外,如图 3(d)所示,正如预期,对照组的DPBF均未被氧化,溶液410 nm处的吸光度基本没有发生变化。
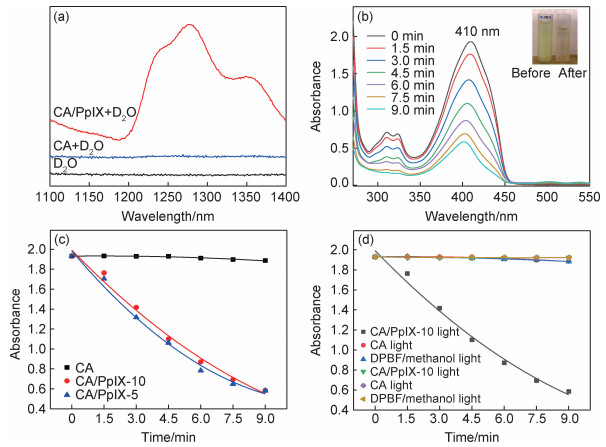
2.4 抗菌及无机盐增强抗菌实验图 4为CA膜、CA/PpIX膜及膜添加无机盐后对金黄色葡萄球菌(S. aureus)和大肠杆菌(E. coli)的抗菌效果图。
|
图 4 CA,CA/PpIX-5和CA/PpIX-10膜对金黄色葡萄球菌及大肠杆菌的抗菌效果图(a)、膜在KI溶液作用下的抗菌效果图(b)及CA/PpIX-5膜在3种无机盐作用下对金黄色葡萄球菌(c)和大肠杆菌(d)的抗菌效果图 Fig. 4 Antibacterial effect of CA/PpIX-5 and CA/PpIX-10 against S.aureus and E.coli. (a), under the influence of KI solution (b), under the action of three inorganic salts against S. aureus(c) and E.coli(d) |
从图 4(a)中可以看出,观察光照条件下两种模式菌的光动力灭活效果发现,CA/PpIX复合纤维膜抗金球菌的效果整体上明显优于抗大肠杆菌。这是由革兰氏阴性菌(G-)与革兰氏阳性菌(G+)结构上的巨大差异造成的。G+的细胞外膜由多层相对疏松多孔的肽聚糖和磷壁酸组成,其分子结构易被光敏剂分子及1O2穿透,而G-的外膜在肽聚糖的基础上,还有脂多糖,脂质双层和脂蛋白[26]。这种高度组织化的特殊结构导致G-对中性或带负电荷的光敏剂介导的光动力抗菌具有非常有效的通透性屏障作用,严重阻碍部分光敏剂分子及活性氧物质穿透其外膜并对其产生光敏抗菌效果。因此,PpIX作为中性光敏剂,CA/PpIX膜对大肠杆菌的抗菌效果不如金球菌。此外,CA/PpIX-5对两种模式菌的抗菌效果均优于CA/PpIX-10,如图 4(a),CA/PpIX-5对金球菌抗菌效率为99.537%,对大肠杆菌的抗菌效率为86.617%,而CA/PpIX-10对金球菌的抗菌效率为96.127%,对大肠杆菌仅有61.403%,证明了光敏剂含量并不与单线态氧的产量成正比,PpIX的团聚导致CA/PpIX-10膜光敏活性的下降,这个结果也与前文DPBF底物氧化的结果一致。并且暗室条件下的所有纤维膜及光照条件下的纯CA纤维膜均无抗菌效果,说明光敏剂和光照是光动力效应的必要条件。由图 4(b)可知,KI的加入可以显著增强CA/PpIX纤维膜的光动力抗菌效果。就CA/PpIX-5纤维膜而言,抗金球菌时,25 mmol/L的KI溶液就可以根除金球菌,抗菌效率达到99.9999%。而抗大肠杆菌时,要达到同样的抗菌效率则需要更高的KI浓度,100 mmol/L的KI溶液才能根除大肠杆菌。至于CA/PpIX-10纤维膜,要想达到与CA/PpIX-5纤维膜相同的抗菌效果,所需KI浓度则更高。KI增强光动力抗菌效果的原因在于其可以与1O2反应产生新的自由基,稳定的抗菌物种碘分子(I2和I3)、次碘酸(HOI-)、过氧化氢自由基(HOO·),以及短时间存在的活性碘自由基(I·和I2-·)[27]。这些活性物种的产生可在一定程度上克服1O2的扩散距离有限的缺点,增加ROS的转移能力。单线态氧氧化碘离子增强光动力抗菌效果的可能机制如式(2), (3)所示[28]:
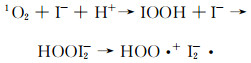
|
(2) |
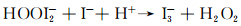
|
(3) |
图 4(c),(d)是MgCl2和NaNO2溶液对CA/PpIX-5纤维膜的光动力抗菌增强效果图。当MgCl2溶液(0~100 mmol/L)加入到纤维膜中时,发现其对抗大肠杆菌的增强作用并不明显,而对金球菌则有更强的光动力灭活作用,在MgCl2为100 mmol/L时,金球菌的抗菌效率由99.537%增强至99.999%。MgCl2与KI同属卤族化合物,氯离子增强光敏抗菌作用可能在于包括次氯酸根(ClO-)在内的氧化氯物种的产生[27]。而NaNO2与MgCl2对两种模式菌光动力灭活的增强作用正相反,其对抗大肠杆菌的增强效果更明显,NaNO2溶液浓度为100 mmol/L时,对大肠杆菌的抑菌率由86.617%增强至99.747%。NaNO2的增强作用可能是由亚硝酸根引起的,NO2-与光动力过程中产生的ROS发生反应,该过程最初导致二氧化氮自由基的产生,随后生成比单线态氧更强的氧化剂过氧亚硝酸盐[29]。此外,光照条件下的无机盐溶液及无机盐+ CA膜对金球菌及大肠杆菌均无任何抗菌效果,说明KI本身不会对细胞造成损伤,也不会与空气中的氧反应或与CA作用产生杀菌物质,排除了PpIX与KI相互作用之外的干扰因素。
通过对比3种无机盐溶液对CA/PpIX-5膜介导的光动力抗菌的增强作用发现,如图 4(c),(d)所示,卤化物对光动力效应的增强效果要强于亚硝酸盐。其原因可能在于光敏剂激发机理与无机盐的氧化机理之间的关系。研究表明,由原卟啉介导的细胞杀伤作用主要是1O2引起光损伤的结果(Ⅱ型机制)[21],而NaNO2的氧化机理主要归因于Ⅰ型机制产生的超氧化物与二氧化氮反应形成过氧亚硝酸盐[29];卤化物阴离子的氧化机理在于与Ⅱ型光化学过程中的1O2反应,继而产生抗菌物质。
3 结论(1) 通过静电纺丝法成功制备了负载原卟啉PpIX的多孔醋酸超细纤维,光敏剂PpIX均匀分布在纤维表面,且复合CA/PpIX纤维实现了表面造孔,纤维直径为微米级,沿纤维轴向分布着大小深浅不一的微米级孔洞,具有良好的表面形貌及纤维结构。
(2) 含PpIX的多孔醋酸纤维膜在光照条件下可产生1O2,具有光动力氧化性能,能够介导革兰氏阳性金黄色葡萄球菌和革兰氏阴性大肠杆菌的光动力失活。由于PpIX为中性光敏剂且在浓度高时易发生聚集现象,故CA/PpIX-5的单线态氧产率高于CA/PpIX-10,且CA/PpIX纤维膜抗金黄色葡萄球菌的效果整体上明显优于抗大肠杆菌。
(3) KI, MgCl2, NaNO2溶液对CA/PpIX介导的光动力抗菌均具有一定的增强作用,其中KI溶液的增强作用最明显,100 mmol/L的KI溶液可将复合纤维膜对两种模式菌的抗菌效率均提升至99.9999%,其机理涉及分子碘的原位光生,将来可能会广泛应用于临床治疗。
| [1] |
LAXMINARAYAN R, MATSOSO P, PANT S, et al. Access to effective antimicrobials: a worldwide challenge[J]. The Lancet, 2015, 387(10014): 168-175. |
| [2] |
RENWICK M J, SIMPKIN V, MOSSIALOS E. Targeting innovation in antibiotic drug discovery and development: the need for a one health-one europe-one world framework[M]. Copenhagen: European Observatory on Health Systems and Policies, 2016.
|
| [3] |
JORI G. Photodynamic inactivation of microbial pathogens medical and environmental applications: light strikes back microorganisms in the new millennium[J]. Photochemistry and Photobiology, 2011, 87(6): 1479-1479. DOI:10.1111/j.1751-1097.2011.01010.x |
| [4] |
董建成, 葛孝栋, 王清清, 等. 阳离子光敏抗菌型水凝胶的制备及性能表征[J]. 材料工程, 2019, 47(2): 56-61. DONG J C, GE X D, WANG Q Q, et al. Preparation and property characterization of cationic photoantimicrobial hydrogel[J]. Journal of Materials and Engineering, 2019, 47(2): 56-61. DOI:10.3969/j.issn.1673-1433.2019.02.017 |
| [5] |
ABRAHAMSE H, HAMBLIN M R. New photosensitizers for photodynamic therapy[J]. Biochemical Journal, 2016, 473(4): 347-364. DOI:10.1042/BJ20150942 |
| [6] |
丁慧颖. 光动力治疗基本原理及其应用[M]. 北京: 化学工业出版社, 2014. DING H Y. Photodynamic therapy: basic principles and applications[M]. Beijing: Chemical Industry Press, 2014. |
| [7] |
周盼, 谢小燕, 熊力, 等. 抗菌光敏剂的分类及研究进展[J]. 激光生物学报, 2017, 26(3): 193-197. ZHOU P, XIE X Y, XIONG L, et al. The classification of antibacterial photosensitizer and its research progress[J]. Acta Laser Biology Sinica, 2017, 26(3): 193-197. DOI:10.3969/j.issn.1007-7146.2017.03.001 |
| [8] |
HARRIS F, PIERPOINT L. Photodynamic therapy based on 5-aminolevulinic acid and its use as an antimicrobial agent[J]. Med Res Rev, 2012, 32(6): 1292-1327. DOI:10.1002/med.20251 |
| [9] |
于宾, 焦晓宁, 王忠忠. 静电纺醋酸纳米纤维及其应用研究现状[J]. 产业用纺织品, 2013(3): 1-5. YU B, JIAO X N, WANG Z Z. The research of electrospun cellulose acetate nanofiber and its application[J]. Technical Textiles, 2013(3): 1-5. DOI:10.3969/j.issn.1004-7093.2013.03.001 |
| [10] |
刘照伟, 汤玉斐, 赵康. 静电纺丝制备多孔纳米纤维的研究进展[J]. 中国材料进展, 2018, 37(6): 410-418. LIU Z W, TANG Y F, ZHAO K. Progress of electrospun nano-fibers with porous structure[J]. Materials China, 2018, 37(6): 410-418. |
| [11] |
OGILBY P R. Singlet oxygen: there is still something new under the sun, and it is better than ever[J]. Photochemical and Photobiological Sciences, 2010, 9(12): 1543-1560. DOI:10.1039/c0pp00213e |
| [12] |
MALIK Z, LADAN H, NITZAN Y, et al. Photodynamic inactivation of gram-negative bacteria: problems and possible solutions[J]. Journal of Photochemistry and Photobiology B, 1992, 14(3): 262-266. DOI:10.1016/1011-1344(92)85104-3 |
| [13] |
NIR U, LADAN H, MALIK Z, et al. In vivo effects of porphyrins on bacterial DNA[J]. Journal of Photochemistry & Photobiology B, 1992, 11(3/4): 295-306. |
| [14] |
GIULIO B, FRANCESCA R, GIULIANA V, et al. Photosensitizing activity of water-souble and lipid-soluble phthalocyanines on Escherichia coli[J]. Fems Microbiology Letters, 1990, 71(1/2): 149-155. |
| [15] |
Vecchio D, Gupta A, Huang L, et al. Bacterial photodynamic inactivation mediated by methylene blue and red light is enhanced by synergistic effect of potassium iodide[J]. Antimicrobial Agents and Chemotherapy, 2015, 59(9): 5203-5212. DOI:10.1128/AAC.00019-15 |
| [16] |
HUANG Y, CHOI H, KUSHIDA Y, et al. Broad-spectrum antimicrobial effects of photocatalysis using titanium dioxide nanoparticles are strongly potentiated by addition of potassium iodide[J]. Antimicrobial Agents and Chemotherapy, 2016, 60(9): 5445-5453. DOI:10.1128/AAC.00980-16 |
| [17] |
HUANG L, DENIS T G, XUAN Y, et al. Paradoxical potentiation of methylene blue-mediated antimicrobial photodynamic inactivation by sodium azide: role of ambient oxygen and azide radicals[J]. Free Radical Biology and Medicine, 2012, 53(11): 2062-2071. DOI:10.1016/j.freeradbiomed.2012.09.006 |
| [18] |
李琪, 魏取福, 汪莹莹, 等. 锦纶6/有机蒙脱土复合纳米纤维的制备与表征[J]. 纺织学报, 2007, 28(11): 1-4. LI Q, WEI Q F, WANG Y Y, et al. Preparation and characterization of PA 6/organic montmorillonite composite nanofibers[J]. Journal of Textile Research, 2007, 28(11): 1-4. DOI:10.3321/j.issn:0253-9721.2007.11.001 |
| [19] |
陈亚君, 汪帝, 李大伟, 等. 梯度孔隙结构二醋酸纤维复合滤料的制备及过滤性能[J]. 现代化工, 2019, 39(2): 136-139. CHEN Y J, WANG D, LI D W, et al. Fabrication of cellulose diacetate composite filter material with pore diameter gradient structure and filtration performance[J]. Modern Chemical Industry, 2019, 39(2): 136-139. |
| [20] |
巫晓华. 静电纺丝制备醋酸纤维素纳米纤维及其抗菌改性[D]. 杭州: 浙江理工大学, 2015. WU X H. The preparation of CA nanofiber by electrospinning and the modification of antibacterial properties[D]. Hangzhou: Zhejiang Sci-Tech University, 2015. |
| [21] |
RICCHELLI F. Photophysical properties of porphyrins in biological membranes[J]. Journal of Photochemistry and Photobiology B-biology, 1995, 29(2/3): 109-118. |
| [22] |
DONG J, GHILADI R A, WANG Q, et al. Protoporphyrin Ⅸ conjugated bacterial cellulose via diamide spacer arms with specific antibacterial photodynamic inactivation against Escherichia coli[J]. Cellulose, 2018, 25(3): 1673-1686. DOI:10.1007/s10570-018-1697-3 |
| [23] |
殷耀兵, 谢辉, 马建华, 等. 原卟啉Ⅸ锌-聚乳酸的合成及表征[J]. 化工新型材料, 2012, 40(3): 97-99. YIN Y B, XIE H, MA J H, et al. Synthesis and characterization of zinc protoporphyrin Ⅸ bearing polylactic acid[J]. New Chemical Materials, 2012, 40(3): 97-99. DOI:10.3969/j.issn.1006-3536.2012.03.031 |
| [24] |
FELGENTRAGER A, MAISCH T, SPATH A, et al. Singlet oxygen generation in porphyrin-doped polymeric surface coating enables antimicrobial effects on Staphylococcus aureus[J]. Physical Chemistry Chemical Physics, 2014, 16(38): 20598-20607. DOI:10.1039/C4CP02439G |
| [25] |
FENG Z, LIU X, TAN L, et al. Electrophoretic deposited stable chitosan@MoS2 coating with rapid in situ bacteria-killing ability under dual-light irradiation[J]. Small, 2017, 14(21): 1-16. |
| [26] |
MAISCH T, SZEIMIES R M, JORI G, et al. Antibacterial photodynamic therapy in dermatology[J]. Photochemical & Photobiological Sciences, 2004, 3(10): 907-917. |
| [27] |
HAMBLIN M, ABRAHAMSE H. Inorganic salts and antimicrobial photodynamic therapy: mechanistic conundrums?[J]. Molecules, 2018, 23(12): 1-18. |
| [28] |
HUANG L, SZEWCZYK G, SARNA T, et al. Potassium iodide potentiates broad-spectrum antimicrobial photodynamic inactivation using photofrin[J]. ACS Infectious Diseases, 2017, 3(4): 320-328. DOI:10.1021/acsinfecdis.7b00004 |
| [29] |
FONTANA M, BLARZINO C, PECCI L, et al. Formation of 3-nitrotyrosine by riboflavin photosensitized oxidation of tyrosine in the presence of nitrite[J]. Amino Acids, 2012, 42(5): 1857-1865. DOI:10.1007/s00726-011-0905-3 |
 2021, Vol. 49
2021, Vol. 49


