文章信息
- 汤桂平, 严倩, 刘洁, 宋波, 文世峰, 史玉升
- TANG Gui-ping, YAN Qian, LIU Jie, SONG Bo, WEN Shi-feng, SHI Yu-sheng
- 3D打印琼脂糖和海藻酸钠复合水凝胶组织与性能研究
- Microstructure and properties of 3D printed agarose and sodium alginate composite hydrogel
- 材料工程, 2021, 49(5): 66-74
- Journal of Materials Engineering, 2021, 49(5): 66-74.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2020.000011
-
文章历史
- 收稿日期: 2020-01-03
- 修订日期: 2020-06-28
人体组织器官缺损或功能衰竭严重威胁着人类生命,对于终末期器官衰竭的患者来说,器官移植是最好的办法,有时也是唯一的治疗手段[1]。然而全球范围内器官供体的极大缺口严重地限制了器官移植学科的发展,无法满足广大病人的移植需求。组织工程是以重构工程化组织或器官、实现人类或动物缺损以及功能衰竭器官替换为目的,融合了生物材料工程学、医学和细胞生物学等学科的一种极具治疗应用前景的技术[2-4]。作为一门交叉学科,组织工程需要在体外构建接种组织或器官特异性细胞的支架,经体外培养后通过外科手术植入体内,支架在体内逐渐被降解和代谢的同时,封装的细胞逐渐分化成相应的组织或器官,取代病变或缺损部位[5],维持人体正常生理功能。由于器官移植存在着疾病传播风险、异体排斥反应和供体严重不足等问题,组织工程成为器官缺损或功能衰竭最有潜力的治疗手段,因而引起了人们的广泛兴趣[6]。
近些年对组织工程的研究尽管取得了较大发展,但是仍然面临许多问题,距离实际的临床应用还存在较大差距[7]。存在的问题包括缺乏具有合适力学性能、生化性质的生物材料,以及材料普遍较差的成形性能等。用于组织工程支架的生物材料要求具有生物相容性、可降解性和与原组织器官相匹配的力学性能。在多种生物材料中,水凝胶由于具备一定的机械强度和天然生物材料的优势,能够很好地在体外模拟细胞外基质的功能,因此制备的组织工程支架在软组织修复方面取得了良好效果[8-10]。Nguyen等[11]制备了纳米原纤化纤维素/藻酸盐和纳米原纤化纤维素/透明质酸,把人源诱导的多能干细胞和经辐照的人软骨细胞封装在水凝胶中,并通过生物3D打印技术打印出来。结果显示,纳米原纤化纤维素/透明质酸在打印后改变了细胞表型,并且细胞的增殖率较低。而封装在纳米原纤化纤维素/海藻酸盐中的细胞能够保留其表型,且产生了具有Ⅱ型胶原蛋白表达的软骨组织,细胞数量显著增加。Yang等[12]比较了纯海藻酸钠凝胶、胶原/海藻酸钠复合凝胶以及琼脂糖/海藻酸钠复合凝胶3D打印软骨支架的性能。结果表明,相对纯海藻酸钠凝胶,胶原/海藻酸钠复合凝胶和琼脂糖/海藻酸钠复合凝胶制备的支架力学性能均有所改善。且在3种支架中,胶原/海藻酸钠复合凝胶在促进细胞黏附、加速细胞增殖和增强软骨特异性基因的表达上具有显著优势。Lopez-marcial等[13]比较了Pluronic F-127水凝胶、不同浓度的琼脂糖以及不同比例的琼脂糖-海藻酸钠复合水凝胶作为软骨组织工程生物材料的性能,包括力学性能、打印性能和细胞活性,结果显示琼脂糖/海藻酸钠复合水凝胶具有较大潜力。
由于海藻酸盐先天的生物相容性、低细胞毒性、高含水量以及快速凝胶化能力,广泛应用于生物医疗领域。然而海藻酸盐的强度较低,无法与人体组织相匹配,限制了其作为组织工程材料的应用[14]。琼脂糖是一种无毒的天然多糖材料,依靠氢键保证结构稳定,物理性能随温度变化明显,冷却后强度显著提高。本工作采用琼脂糖来增强海藻酸钠水凝胶的机械强度,利用3D打印的方法成形海藻酸钠/琼脂糖复合凝胶,并在复合凝胶支架中加入碳酸钙,得到微观孔隙以便于细胞的黏附和生长。此外,分析不同比例海藻酸钠和琼脂糖复合水凝胶的结构变化,包括官能团、含水量以及微观形貌等。同时,为了使复合凝胶达到实际应用要求的力学性能,研究不同温度、不同比例的海藻酸钠和琼脂糖复合凝胶压缩模量的变化。
1 实验材料与方法 1.1 材料与试剂海藻酸钠(SA),化学纯,国药集团化学试剂有限公司;琼脂糖(A),99.9%,湖北信康医药化工有限公司;无水氯化钙,分析纯,国药集团化学试剂有限公司;碳酸钙,分析纯,国药集团化学试剂有限公司;去离子水。所有试剂均不做进一步处理。
1.2 复合水凝胶的制备和性能表征海藻酸钠、琼脂糖、无水氯化钙分别与去离子水混合均匀,配制成5%(质量分数,下同)海藻酸钠溶液、5%琼脂糖溶液和2%氯化钙溶液。把琼脂糖溶液与海藻酸钠溶液按体积比1∶0,3∶1,2∶1,3∶2,1∶1,1∶2,0∶1分别混合均匀,并静置至少2 h。将5%的海藻酸钠溶液稀释到0.5%后,使用圆二色谱仪(J-810)测试得到的海藻酸钠对波长范围在190~260 nm的电磁波的吸收图谱。在温度为25 ℃、pH=7、相对湿度为50%时,使用式(1)[15]计算海藻酸钠中古洛糖醛酸含量x。

|
(1) |
式中:P是圆二色光谱中手性分子两个吸收峰的高度差;T是光谱图像中稳定值和负峰之间的深度; r为置信度。升高温度,分别在40,60 ℃和80 ℃测试海藻酸钠手性分子的含量。
为了测定不同比例海藻酸钠/琼脂糖复合凝胶含水量的变化情况,把上述不同比例的复合凝胶与氯化钙溶液完全交联后,倒入模具中形成块体,用去离子水清洗后吸取试样表面的水分,得到湿重W1,冷冻干燥后,再次称重记为W2。
复合凝胶的含水量CW为:

|
(2) |
为了研究海藻酸钠/琼脂糖复合凝胶的化学成分变化,将不同比例的复合凝胶材料与氯化钙交联后进行冷冻干燥,使用VERTEX 70傅里叶变换显微红外光谱仪测试试样对电磁波的吸收率,波长范围为500~4000 cm-1。凝胶材料冷冻干燥后进行喷金处理,使用场发射扫描电镜观察干燥凝胶表面和断面微观形貌,并对样品特定部位进行点元素分析。在室温下将5%的海藻酸钠溶液以及不同比例的海藻酸钠/琼脂糖复合凝胶浇入模具,再用氯化钙溶液完全交联,使用E1000电子动静态疲劳试验机测试其压缩性能,压缩速率为10 mm/min。
1.3 3D打印成形利用本实验室组装的直写打印设备成形复合凝胶,如图 1所示。打印速率为20 mm/s,针嘴内径为210 μm,每层Z轴上升高度为100 μm,气压为482.65 kPa(70 psi),打印间距为3 mm。
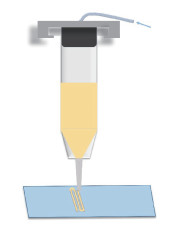
|
图 1 水凝胶直写打印示意图 Fig. 1 Schematic diagram of printing the hydrogel by direct ink writing |
把质量比分别为10∶1和5∶1海藻酸钠与碳酸钙均匀混合,加入去离子水制备成海藻酸钠为5%的均匀溶液, 然后把这两种比例的混合溶液与5%的琼脂糖溶液以海藻酸钠与琼脂糖体积比为2∶1的比例均匀混合制成复合凝胶,把这两种比例的复合凝胶标记为1#和2#凝胶,再把没有碳酸钙的海藻酸钠溶液与琼脂糖溶液体积比为2∶1的复合凝胶标记为3#凝胶。利用直写打印成形后,分别浸入氯化钙溶液完全交联,经冷冻干燥后喷金处理,使用场发射扫描电镜分析干燥凝胶表面和断面微观形貌。
2 结果与分析 2.1 海藻酸钠中古洛糖醛酸含量及温度对结构的影响海藻酸钠是一种存在于海藻中的生物聚合物,通常从褐藻中提取出来[16]。其分子由甘露糖醛酸(M段)和古洛糖醛酸(G段)按1→4键连接而成,其中G段可与二价阳离子,如钙离子反应形成三维凝胶网络。高G段含量的海藻酸钠与钙离子交联后形成的水凝胶硬度和脆性大,而高M段含量海藻酸钠形成的水凝胶硬度较小,但弹性好。图 2为海藻酸钠溶液圆二色光谱图。由图 2(a)可以看出,海藻酸钠在波长200 nm和212 nm附近分别有一强正吸收峰和负吸收峰,分别表示其内部的两种手性分子。根据式(1)计算得到海藻酸钠中古洛糖醛酸含量为47.38%,为高M型海藻酸钠,交联后制备的凝胶比高G型弹性更好,更容易产生变形。

|
图 2 海藻酸钠溶液圆二色光谱图 (a)25 ℃时古洛糖醛酸含量计算原理图;(b)不同温度的光谱比较 Fig. 2 Circular dichroism spectra of sodium alginate solution (a)calculation schematic diagram of guluronic acid content at 25 ℃; (b)comparison of spectra at different temperatures |
从图 2(b)中可以发现,温度达到60 ℃时,波长为190~195 nm之间时吸收光谱已经发生明显变化。而当继续升温至80 ℃时,海藻酸钠中甘露糖醛酸对应的正吸收峰明显降低,说明M段含量已经发生变化,但是古洛糖醛酸对应的负吸收峰并未产生明显改变。实验中也发现,当海藻酸钠溶液加热至80 ℃以上时,浓度与黏性均明显降低。
2.2 不同比例复合凝胶对含水量的影响海藻酸钠与氯化钙溶液发生离子交联反应生成海藻酸钙凝胶,如图 3所示。可以看到,不同比例的海藻酸钠/琼脂糖复合凝胶、纯海藻酸钙水凝胶以及纯琼脂糖水凝胶的含水量差别不明显,均处于90%左右,能满足细胞质基质的含水量要求。但与两种纯凝胶相比,复合凝胶的含水量都有所降低,这可能与两种凝胶复合以后交联密度增加有关。
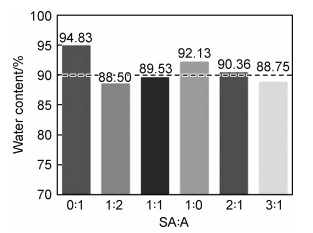
|
图 3 不同体积比的海藻酸钠与琼脂糖复合凝胶含水量 Fig. 3 Water content in sodium alginate and agarose composite hydrogels with different volume ratios |
图 4为不同比例海藻酸钠/琼脂糖复合水凝胶红外吸收光谱图,为了便于观察特征峰,横坐标采用对数坐标表示。可以发现,复合凝胶的官能团主要是海藻酸钙和琼脂糖的叠加,当海藻酸钠与琼脂糖体积比变化后,其吸收峰并未发生明显变化。但与纯凝胶相比,复合凝胶中出现了部分官能团的新增或消失。以体积比为1∶1的复合凝胶为例,分析海藻酸钠与琼脂糖混合后官能团的变化情况。从图 4(b)可以看到,海藻酸钠和琼脂糖中的大部分特征吸收峰都可以在复合凝胶中找到,仅发生了红移和蓝移现象,吸收强度是两种物质强度的叠加。但琼脂糖中的亚甲基不对称伸缩振动νas(CH2)、甲基对称伸缩振动νs(CH3)、海藻酸钠中的芳香酮面内弯曲振动δC—CO—C以及两种物质均含有的环上CC面外弯曲振动δCC消失,说明混合以后两种物质中的某些基团发生了键合。
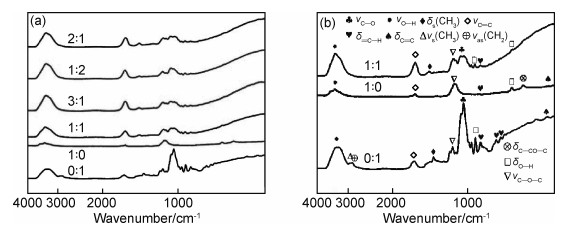
|
图 4 不同比例海藻酸钠/琼脂糖复合水凝胶红外吸收光谱图 (a)所有试样; (b)体积比为1∶1,1∶0和0∶1的海藻酸钠/琼脂糖复合水凝胶 Fig. 4 Infrared absorption spectra of sodium alginate/agarose composite hydrogels with different volume ratios (a)all samples; (b)sodium alginate/agarose composite hydrogels with volume ratio of 1∶1, 1∶0 and 0∶1 |
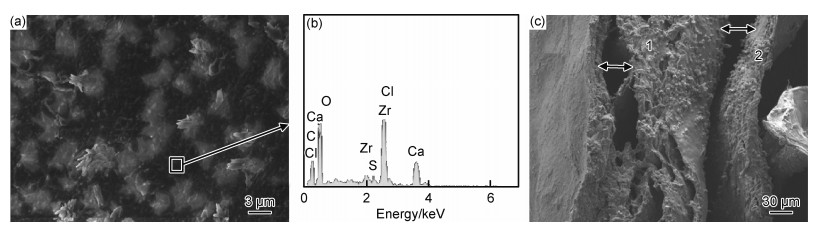
使用场发射扫描电镜和EDS能谱分析研究凝胶微观形貌和元素组成,并测量断面中孔隙的大小。图 5~7分别为纯海藻酸钠与氯化钙溶液交联后产生的海藻酸钙、琼脂糖以及体积比为2∶1的海藻酸钠/琼脂糖复合凝胶的微观形貌和EDS能谱分析,表 1为水凝胶的孔隙尺寸。可知,图 5(a)中的块状和放射状物质均含有氯化钠,大量地黏附在海藻酸钙的表面,从而导致海藻酸钙表面非常粗糙。而海藻酸钙的断面为疏松的层状组织,组织不致密。由图 6可知,琼脂糖表面致密、光滑,并分布有亮线。EDS能谱分析可知,亮线部位成分为琼脂糖。断面为多孔的不规则层片状结构,孔径大小差别很大。
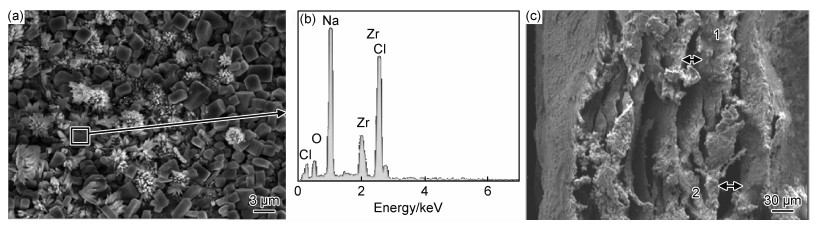
|
图 5 海藻酸钙扫描电镜图及EDS能谱分析 (a)表面SEM图;(b)EDS能谱分析;(c)断面SEM图 Fig. 5 SEM images and EDS energy spectrum analysis of calcium alginate (a)SEM image of surface; (b)EDS energy spectrum analysis; (c)SEM image of cross section |

|
图 6 琼脂糖扫描电镜图及EDS能谱分析 (a)表面SEM图;(b)EDS能谱分析;(c)断面SEM图 Fig. 6 SEM images and EDS energy spectrum analysis of agarose (a)SEM image of surface; (b)EDS energy spectrum analysis; (c)SEM image of cross section |
|
图 7 体积比为2∶1的海藻酸钠/琼脂糖复合凝胶扫描电镜图及EDS能谱分析 (a)表面SEM图;(b)EDS能谱分析;(c)断面SEM图 Fig. 7 SEM images and EDS energy spectrum analysis of sodium alginate/agarose composite hydrogel with volume ratio of 2∶1 (a)SEM image of surface; (b)EDS energy spectrum analysis; (c)SEM image of cross section |
| Position | Calcium alginate/μm | Agarose/μm | Composite hydrogel with a volume ratio of 2∶1/μm |
| 1 | 26 | 133 | 38 |
| 2 | 32 | 91 | 41 |
海藻酸钠与琼脂糖的体积比为1∶2时,试样表面与琼脂糖凝胶类似,比较光滑。断面类似于海藻酸钙,为丝状结构,但较海藻酸钙结构更加致密。当海藻酸钠与琼脂糖的体积比为1∶1时,复合凝胶表面形貌接近海藻酸钙样品,其表面布满氯化钠颗粒。断面也与海藻酸钙样品非常相似,但相对其他试样,其断面孔径尺寸较均匀。当海藻酸钠与琼脂糖的体积比为2∶1时(图 7),复合凝胶的表面比较粗糙,并且有较多放射状物质,其断面类似于海藻酸钙,为层片状结构,且附着有大量颗粒物。通过EDS能谱分析可知,试样骨架上含有大量Ca和Cl,表面放射状物质和断面的多孔层状结构表面附着的颗粒物为氯化钠。当海藻酸钠与琼脂糖的体积比增加至3∶1时,在试样表面发现团聚物,元素中不含有C,而Ca和O含量较高,与体积比为1∶2时复合凝胶表面的亮线部位成分相近,说明复合凝胶与氯化钙反应后会产生氧化物,断面也为多孔的片状组织。
从以上测试结果可以发现,除了纯琼脂糖凝胶和体积比为1∶2的复合凝胶外,其他复合凝胶的表面和断面均比较粗糙,说明琼脂糖会使复合凝胶变得光滑,因此,琼脂糖的添加量不宜过多。不同比例的复合凝胶上均附着有氯化钠或氯化钙等颗粒,这些颗粒使复合凝胶变得非常粗糙,有利于细胞的黏附。
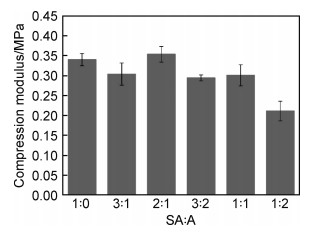
2.5 复合水凝胶的力学性能用作植入物的组织支架必须要有足够的力学性能,以维持其物理完整性,甚至承受一定的负载[17]。海藻酸钠凝胶及其他用于组织工程的海藻酸钠复合凝胶弹性模量均较低[12, 18-20],一般不足0.3 MPa。研究表明,水凝胶的模量跟交联密度、交联剂类型、聚合物成分和分子量分布有关[21]。
图 8为不同体积比海藻酸钠/琼脂糖复合水凝胶的压缩模量图。可知,5%的纯海藻酸钠水凝胶的压缩模量为0.339 MPa。加入琼脂糖以后,大部分复合凝胶的压缩模量都在一定程度上出现下降,但体积比为2∶1的海藻酸钠/琼脂糖复合凝胶逆势上升,超过纯海藻酸钠,达到了0.353 MPa。由前述可知,加入琼脂糖以后的复合凝胶含水量有所下降,可能是因为交联度的增加导致模量上升。而根据电镜图可知海藻酸钠断面是一种疏松的片状组织,加入少量低浓度的琼脂糖后可能有两种影响:1)相对致密的琼脂糖组织填补在海藻酸钠的间隙中与之结合,并发生官能团反应,从而提高了复合凝胶的力学性能;2)琼脂糖与海藻酸钠混合后,两种凝胶的连续性遭到破坏,界面结合效果差,反而降低了力学性能。复合凝胶的力学性能是这几种因素综合作用的结果。体积比为2∶1的海藻酸钠/琼脂糖复合凝胶逆势上升,可能是因为交联度增加和官能团反应因素占了主导作用。
|
图 8 不同体积比海藻酸钠/琼脂糖复合水凝胶的压缩模量 Fig. 8 Compression modulus of sodium alginate/agarose composite hydrogels with different volume ratios |
直写打印技术通过计算机实体几何建模,精确堆积材料,快速制造出任意复杂形状部件,可以满足组织工程支架高孔隙率、精确控制孔结构、外形自由设计等个性化定制要求。通过调节挤出成形工艺参数,打印出具有一定形状的水凝胶支架。
打印所使用的材料是海藻酸钠/琼脂糖体积比为2∶1的复合水凝胶。影响打印成形效果的因素主要有材料本身的流变性能、黏度,以及针管直径、气压、打印间距等打印工艺。由于复合凝胶比纯海藻酸钠溶液黏度低,在使用相同大小的针管直径条件下,用较小压强就能被挤出。在单层打印实验中发现,压强越大,挤出的凝胶单条直径越大,而针管移动的速度对挤出成形效果无显著影响。
在多层打印实验中发现,随着打印层数的增加,由于不能及时固化,凝胶会在重力作用下出现塌陷现象,实际的材料叠加高度比设计低,因此在打印时需要选择合适的Z轴上升高度。由于含有琼脂糖,复合凝胶支架不需要钙离子就已经凝固,而纯海藻酸钠溶液需要喷洒氯化钙溶液才能固化。如图 9所示,其他条件相同,仅改变针嘴直径打印了复合凝胶支架,支架均保持了较好的形状和尺寸精度。

|
图 9 不同直径的针嘴3D打印成形复合水凝胶支架 (a)340 μm;(b)250 μm;(c)210 μm Fig. 9 Composite hydrogel scaffolds formed by 3D printing with different diameter nozzles (a)340 μm; (b)250 μm; (c)210 μm |
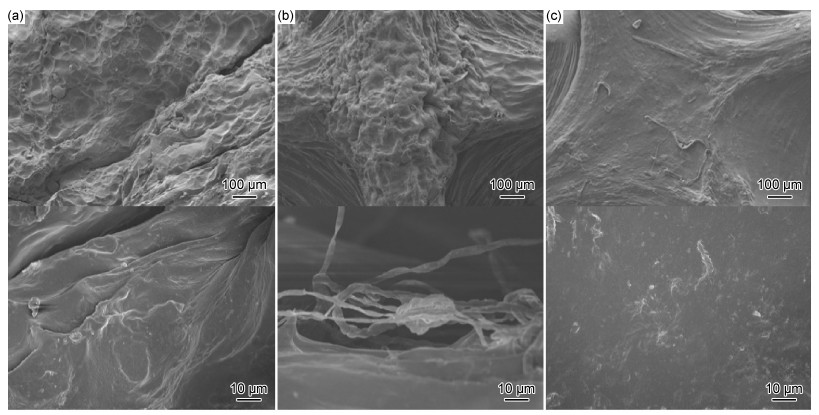
组织工程支架不但对材料的性能和形状尺寸等有要求,而且还要求支架具有一定的孔隙率,增大表面积用以封装细胞,并为细胞生长繁殖提供空间和必需的营养输送通道。3D打印可以成形出具有一定孔隙的三维支架,但是这一工艺能成形的空隙过大,一般超过100微米级,无法实现更小孔隙的成形。因此,本工作通过在水凝胶中加入碳酸钙,使其在酸性环境下产生二氧化碳气体,从而在复合凝胶中产生所需的微观孔隙。图 10为不同质量比海藻酸钠/碳酸钙复合水凝胶的电镜表面形貌。如图 10(a),(b)所示,海藻酸钠与碳酸钙质量比为1∶0和10∶1的试样表面粗糙,而质量比为5∶1的试样(图 10(c))表面相对光滑。放大倍数增加到1000倍时,可以看到质量比为10∶1的试样表面存在丝状物质,相互缠结,而质量比为1∶0和5∶1的试样均无丝状结构。此外,通过高倍电镜图可以看到质量比为1∶0和10∶1的试样存在坑洞或者凹陷,而质量比为5∶1的试样在100倍和1000倍电镜下表面均没有明显凹陷。
|
图 10 不同质量比海藻酸钠/碳酸钙复合水凝胶的表面形貌 (a)1∶0;(b)10∶1;(c)5∶1 Fig. 10 Surface morphologies of sodium alginate/calcium carbonate composite hydrogels with different mass ratios (a)1∶0;(b)10∶1;(c)5∶1 |
图 11为不同质量比海藻酸钠/碳酸钙复合水凝胶的断面形貌。使用电镜观察支架断面时发现,3种质量比的试样断面均比较粗糙。由图 11(b),(c)可知,10∶1和5∶1的断面有明显孔隙,孔径在微米至亚微米级。在10∶1的试样断面上可以清晰地观察到支架内部有大量的网状结构,而在5∶1的支架中未发现网状结构。由图 11(a)可知,1∶0的断面和表面微观形貌相近,凹凸不平, 但只有少量孔隙。

|
图 11 不同质量比海藻酸钠/碳酸钙复合水凝胶的断面形貌 (a)1∶0;(b)10∶1;(c)5∶1 Fig. 11 Cross section morphologies of sodium alginate/calcium carbonate composite hydrogels with different mass ratios (a)1∶0;(b)10∶1;(c)5∶1 |
结合表面图和断面图,相对海藻酸钠与碳酸钙质量比为1∶0和5∶1的试样,质量比为10∶1的试样表面更粗糙,有较多相互缠结的丝状结构和不规则凹陷,内部为网状结构,含有较多孔隙。粗糙的表面和丝状组织可以更好地黏附细胞,有利于细胞的生长增殖。内部的大量微观孔隙不但为细胞的生长增殖提供更多的空间,更为营养物质的输送提供通道,因此质量比为10∶1的试样特征可为细胞的黏附和生长提供良好的结构基础。
3 结论(1) 复合凝胶内部存在海藻酸钠/氯化钙离子交联和海藻酸钠/琼脂糖基团两种网络。
(2) 不同比例的海藻酸钠/琼脂糖复合凝胶含水量差异较小,均处于90%左右。
(3) 不同比例的海藻酸钠与琼脂糖对复合凝胶的性能均有较大的影响。其中,海藻酸钠与琼脂糖的体积比为2∶1的复合凝胶压缩模量最高,达到0.353 MPa。
(4) 加入碳酸钙后复合凝胶中出现亚微米级孔隙。海藻酸钠与碳酸钙质量比为10∶1的复合凝胶表面粗糙,断面多孔,支架内部存在大量网状组织,这些特征可以为细胞黏附和生长提供良好的结构基础。
| [1] |
RUDGE C, MATESANZ R, DELMONICO F L, et al. International practices of organ donation[J]. British Journal of Anaesthesia, 2012, 108(Suppl 1): 48-55. |
| [2] |
KHOJASTEH A, BEHNIA H, DASHTI S G, et al. Current trends in mesenchymal stem cell application in bone augmentation: a review of the literature[J]. Journal of Oral and Maxillofacial Surgery, 2012, 70(4): 972-982. DOI:10.1016/j.joms.2011.02.133 |
| [3] |
KHOJASTEH A, BEHNIA H, NAGHDI N, et al. Effects of different growth factors and carriers on bone regeneration: a systematic review[J]. Oral Surgery, Oral Medicine, Oral Pathology and Oral Radiology, 2013, 116(6): 405-423. DOI:10.1016/j.oooo.2012.01.044 |
| [4] |
SHAYESTEH Y S, KHOJASTEH A, SOLEIMANI M, et al. Sinus augmentation using human mesenchymal stem cells loaded into a beta-tricalcium phosphate/hydroxyapatite scaffold[J]. Oral Surgery, Oral Medicine, Oral Pathology, Oral Radiology and Endodontology, 2008, 106(2): 203-209. DOI:10.1016/j.tripleo.2007.12.001 |
| [5] |
SHIEH S J, VACANTI J P. State-of-the-art tissue engineering: from tissue engineering to organ building[J]. Surgery, 2005, 137(1): 1-7. DOI:10.1016/j.surg.2004.04.002 |
| [6] |
GRIFFITH L G, NAUGHTON G. Tissue engineering-current challenges and expanding opportunities[J]. Science, 2002, 295(5557): 1009-1014. DOI:10.1126/science.1069210 |
| [7] |
KHADEMHOSSEINI A, LANGER R. A decade of progress in tissue engineering[J]. Nature Protocols, 2016, 11(10): 1775-1781. DOI:10.1038/nprot.2016.123 |
| [8] |
LEE K Y, MOONEY D J. Alginate: properties and biomedical applications[J]. Progress in Polymer Science, 2012, 37(1): 106-126. DOI:10.1016/j.progpolymsci.2011.06.003 |
| [9] |
SLAUGHTER B V, KHURSHID S S, FISHER O Z, et al. Hydrogels in regenerative medicine[J]. Advanced Materials, 2009, 21(32/33): 3307-3329. |
| [10] |
ZHAO X, LANG Q, YILDIRIMER L, et al. Photocrosslinkable gelatin hydrogel for epidermal tissue engineering[J]. Advanced Healthcare Materials, 2016, 5(1): 108-118. DOI:10.1002/adhm.201500005 |
| [11] |
NGUYEN D, HAGG D A, FORSMAN A, et al. Cartilage tissue engineering by the 3D bioprinting of iPS cells in a nanocellulose/alginate bioink[J]. Scientific Reports, 2017, 7(1): 658. DOI:10.1038/s41598-017-00690-y |
| [12] |
YANG X, LU Z, WU H, et al. Collagen-alginate as bioink for three-dimensional(3D) cell printing based cartilage tissue engineering[J]. Materials Science and Engineering: C, 2018, 83: 195-201. DOI:10.1016/j.msec.2017.09.002 |
| [13] |
LÓPEZ-MARCIAL G R, ZENG A Y, OSUNA C, et al. Agarose-based hydrogels as suitable bioprinting materials for tissue engineering[J]. ACS Biomaterials Science & Engineering, 2018, 4(10): 610-3616. |
| [14] |
张小林, 王兰兰, 翁林, 等. 海藻酸盐医用材料的制备技术及应用现状[J]. 棉纺织技术, 2019, 47(4): 75-80. ZHANG X L, WANG L L, WENG L, et al. Preparation technology and application status of alginate medical material[J]. Cotton Textile Technology, 2019, 47(4): 75-80. DOI:10.3969/j.issn.1001-7415.2019.04.020 |
| [15] |
JOHNSON F A, CRAIG D Q M, MERCER A D. Characterization of the block structure and molecular weight of sodium alginates[J]. Journal of Pharmacy and Pharmacology, 1997, 49(7): 639-643. |
| [16] |
VENKATESAN J, BHATNAGAR I, MANIVASAGAN P, et al. Alginate composites for bone tissue engineering: a review[J]. International Journal of Biological Macromolecules, 2015, 72: 269-281. DOI:10.1016/j.ijbiomac.2014.07.008 |
| [17] |
WENDT D, JAKOB M, MARTIN I. Bioreactor-based enginee-ring of osteochondral grafts: from model systems to tissue manufacturing[J]. Journal of Bioscience and Bioengineering, 2005, 100(5): 489-494. DOI:10.1263/jbb.100.489 |
| [18] |
任利玲, 冯雪, 马东洋, 等. 不同浓度海藻酸盐凝胶的力学特性及其对软骨细胞增殖能力的影响[J]. 生物医学工程学杂志, 2012, 29(5): 884-888. REN L L, FENG X, MA D Y, et al. Mechanical properties of al-ginate hydrogels with different concentrations and their effects on the proliferation chondrocytes in vitro[J]. Journal of Biomedical Engineering, 2012, 29(5): 884-888. |
| [19] |
KUO C K, MA P X. Ionically crosslinked alginate hydrogels as scaffolds for tissue engineering: part 1.structure, gelation rate and mechanical properties[J]. Biomaterials, 2001, 22: 511-521. DOI:10.1016/S0142-9612(00)00201-5 |
| [20] |
OUWERX C, VELINGS N, MESTDAGH M M, et al. Physico-chemical properties and rheology of alginate gel beads formed with various divalent cations[J]. Polymer Gels and Networks, 1998, 6: 393-408. DOI:10.1016/S0966-7822(98)00035-5 |
| [21] |
AUGST A D, KONG H J, MOONEY D J. Alginate hydrogels as biomaterials[J]. Macromolecular Bioscience, 2006, 6(8): 623-633. DOI:10.1002/mabi.200600069 |
 2021, Vol. 49
2021, Vol. 49


