文章信息
- 田亚强, 赵冠璋, 刘芸, 张源, 郑小平, 陈连生
- TIAN Ya-qiang, ZHAO Guan-zhang, LIU Yun, ZHANG Yuan, ZHENG Xiao-ping, CHEN Lian-sheng
- 生物可降解医用镁合金体内外降解行为研究进展
- Research progress in degradation behavior of biodegradable medical Mg-based alloys in vivo and in vitro
- 材料工程, 2021, 49(5): 24-37
- Journal of Materials Engineering, 2021, 49(5): 24-37.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2020.000338
-
文章历史
- 收稿日期: 2020-04-17
- 修订日期: 2021-01-11
相比于传统医用可植入生物材料(Ti, Co-Cr, 不锈钢,聚合物,陶瓷等)而言,镁合金由于具有优异的力学性能、独特的降解能力以及良好的生物相容性,使其作为体内植入物优于高分子材料、陶瓷材料以及其他金属材料[1]。并且镁合金材料由于具有与人体骨骼相匹配的弹性模量,能够很大程度上避免植入后产生的应力遮挡效应(当两种或多种具有不同刚度的材料共同承载外力时,具有刚度较高的材料将会承担较高的载荷,而刚度较低的材料只需承担较低的载荷)[2]。同时,镁合金在人体服役后,能够发生动态降解行为,其降解产物不会造成人体的过敏反应,且过量的Mg2+通常会通过循环系统排出体外[3],故成为生物医疗器械的首选[4-5]。另外,在细胞毒性方面,镁合金具有良好的细胞相容性,细胞可以在镁合金上有效地附着、扩散以及增殖[6]。此外,在骨修复方面,过量Mg2+富集会刺激脊神经节释放降钙素基因相关肽(calcitonin gene related peptide, CGRP),诱导相关蛋白的产生,促进骨成型[5],因此镁合金常用作骨折内部固定的医疗器械。但是,由于镁化学性质活泼,电位较低(-2.37 V vs SHE(标准氢电极)),在富含Cl-的液体环境中,基体与第二相之间易形成原电池,产生电偶腐蚀,同时生成OH-和H2。伴随着Mg基体缺陷处渗透进入的腐蚀介质对膜结构的共同侵蚀作用,破坏Mg合金基体的完整结构。其反应主要如下所示:
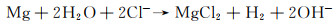
|
(1) |
在骨成型过程中,H2会导致气穴的产生,占据骨痂生长空间,最终影响骨成型的速度与形态[7],目前,在镁合金的研究过程中,鉴于对镁合金降解行为的认知程度匮乏以及降解机理认识的不足,导致镁合金作为植入物在生理环境下的动态降解速率得不到有效控制,降解形貌不均匀。Ding等[6]将Mg-Zn-Ca合金作为手术夹夹闭老鼠颈动脉血管。在3个月时,靠近心脏的一侧出现了明显的断裂行为,主要是由于血液流动产生的脉动应力加快了镁合金手术夹的降解;Wang等[8]将铸态的Mg-Zn-Ca合金植入新西兰白兔左股骨处,并采用Micro-CT系统观察了其在体内的动态降解行为。在第8周时,可以清晰地观察到镁合金种植体表面出现了许多降解坑,降解过快且不均匀;Li等[9]进行了Mg-Zn-Zr合金骨钉在兔骨骨髁部位的体内实验。在兔子体内实验时,螺钉在2个月时便发生严重降解,3个月时发现了颈部骨折,到第6个月时只剩下少量残余合金,进一步证实了镁合金材料降解的过快与不可控性。
此外,为了探究镁合金在生理条件下如何获得最佳的降解性能,国内外学者还进行了大量的体外实验,但部分镁合金在模拟体液环境中仍显示出较快的降解速率以及较严重的降解形貌。目前体外实验的降解速率评定主要通过3种实验途径,分别为浸泡实验、电化学实验以及析氢演变实验,其降解速率的具体计算方法如下[10]:
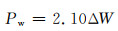
|
(2) |
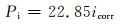
|
(3) |
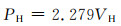
|
(4) |
式中:Pw, Pi, PH分别为3种实验方法测得的降解速率,mm/a;ΔW为失重速率,mg·cm-2/d;icorr为合金的腐蚀电流密度,mg·cm-2;VH为析氢体积,mL·cm-2/d。
体内外降解研究结果表明,镁合金在接近中性生理环境中的降解方式以腐蚀为主,其降解机制如下所示[7]:
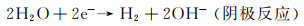
|
(5) |
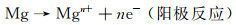
|
(6) |
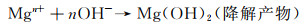
|
(7) |
通常在腐蚀介质中,Mg作为阳极转变为Mg2+与阴极产生的OH-发生反应生成Mg(OH)2,随着浸泡时间的延长,合金表面缺陷处可作为Cl-渗透到膜结构中与Mg(OH)2反应的特殊通道,导致表面产生点蚀现象。另外,基体与第二相(金属间相)会由于电化学电位差异产生以镁基体为阳极的电偶腐蚀,加快合金的降解进程[11]。
为了更好地解决镁合金在生理环境中所出现的降解过快及降解不均匀等问题,本文结合本课题组前期的研究工作(微合金化、纳米HA/CaO微复合、热处理、塑性加工)[12-15],通过对合金的微观、宏观结构与降解速率之间关系的建立,深入分析并探究了合金在生理环境下所发生的静态以及动态降解机制,系统地概括了合金化工艺、热处理工艺、塑性加工工艺和表面改性处理工艺对镁合金体内外降解的影响规律以及耐蚀性能提高的微观机理的研究现状。
1 微合金化工艺通常医用镁合金在未满服役周期前便快速降解,因此,至少在达到预定服役期限之前,需要良好的降解性能来维持植入物在人体使用过程中的完整性。合金化常被作为一种有效的途径来提高镁合金的降解性能。与其他工艺相比,通过适当添加合金元素进行微观组织调控,不仅可以起到改变合金的析出相种类以及合金晶粒度的作用,而且还可以改变表面膜的组成结构,从而达到减缓降解速率的效果。但需要注意的是合金元素的选择问题,镁合金降解后向周围组织释放的其他金属离子可能会在短期或较长时间内引起生物反应,因此合金元素添加不当可能会引起严重的毒物学问题。并且添加的元素如果固溶度过低,这些残留的过量合金元素会导致大量的第二相产生,而过量的第二相会与镁基体形成电偶腐蚀,加快镁合金的降解进程。目前常见的生物医用镁合金主要包含Mg-Ca, Mg-Zn, Mg-Mn, Mg-Sr以及Mg-RE合金,这些经过合金化处理的合金具有良好的生物相容性,对组织无不良影响。
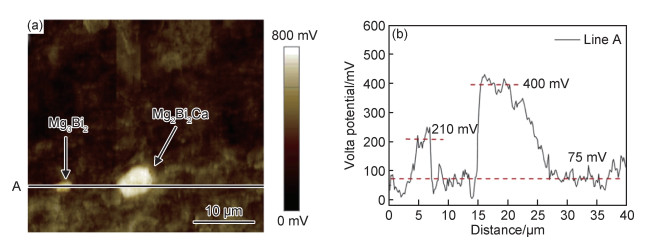
合金化处理对于医用镁合金体内外降解机制的影响主要如下:Ca是人体骨骼的主要成分,对细胞内的化学信号传递至关重要,其释放的离子有利于骨骼固化,是一种矿物质营养素。因此,钙的添加引起了研究学者们的广泛关注。Jeong等[16]对比了在Hank’s溶液中不同Ca含量的添加对铸态以及挤压态Mg-Ca合金降解性能的影响。结果显示当Ca含量增加时(0.4%→1%→2%→3%,质量分数,下同),由电化学实验测得的铸态合金的降解速率也呈现不断升高的趋势(0.161→0.223→0.241→0.585 mm/a),挤压态合金具有相同的变化趋势(0.179→0.193→0.194→0.245 mm/a)。该现象产生的原因主要与Mg2Ca相的析出有关,Ca含量的增加会导致第二相体积分数的增大,基体镁与第二相之间容易发生电偶腐蚀,从而加快了合金降解进程。Mohamed等[17]将铸态Mg-0.8Ca和纯镁在Hank’s平衡盐溶液中的降解速率做了对比。结果显示,Mg-0.8Ca的降解速率大约是纯镁的3倍(Mg-0.8Ca降解速率为(1.08±0.38) mm/a,纯镁降解速率为(0.35±0.17) mm/a)。这同样与晶界处Mg2Ca的产生有关,Mg2Ca相通常作为阴极与阳极的α-Mg发生电偶腐蚀,从而增加了降解速率。但随着浸泡时间的延长,Mg-Ca合金表面除Mg(OH)2保护层外,会伴随有羟基磷灰石的产生,该产物对骨愈合具有明显的促进作用,证实了Mg-Ca合金潜在的植入价值。Liu等[18]在挤压态Mg-1Bi-1Zn合金中加入了0.6%Ca,获得的光学组织与晶粒分布显示,随着微量Ca的加入,会导致合金的平均晶粒尺寸减小,动态再结晶晶粒比例显著增大。去除降解产物的表面SEM形貌如图 1所示,Mg-1Bi-1Zn合金出现很多尺寸较大的点蚀坑,而加入Ca后的合金降解形貌相对比较均匀。且电化学实验测得合金降解速率由0.41 mm/a下降为0.32 mm/a。其产生原因为:加入Ca后生成的第二相粒子Mg2Bi2Ca(相比于Mg3Bi2相)与基体镁相比具有更高的电势差,如图 2中扫描Kelvin探针力显微镜(SKPFM)结果显示,在降解过程中更易作为阴极位置,导致降解产物层的密度更大,形成速度更快。合金表面氧化膜的XPS分析显示,相比于Mg-1Bi-1Zn合金,在Mg-1Bi-1Zn-1Ca合金表面有Ca(OH)2产生,其反应主要如下所示:
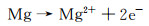
|
(8) |
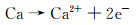
|
(9) |
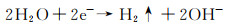
|
(10) |
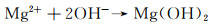
|
(11) |
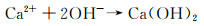
|
(12) |
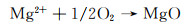
|
(13) |
Ca元素的加入改变了膜层结构,在一定程度上提高了合金降解性能。王勇等[19]研究了Ca含量的添加对于ZM61合金在SBF中降解性能的影响。结果显示,当Ca含量控制在0.5%时,由于晶粒的细化以及晶界处网状析出相的产生,导致其具有最佳的降解抗性。通过以上研究表明:Ca元素的添加可通过调整晶粒度、析出物的形态与类型以及表面产物膜成分,从而在一定程度上提高镁合金的耐蚀性能。同时,一些学者对Mg-Ca合金也进行了相应的体内实验,Xia等[20]将挤压态的Mg-4.0Zn-0.2Ca合金植入家兔股骨处。结果显示合金的植入并未导致任何炎症反应的产生,且骨与种植体之间接触良好。随后利用SEM对植入3个月的种植体进行了表面形貌的观察,发现在种植体表面产生了保护膜。利用EDS分析了保护膜的成分组成,结果显示保护膜主要成分为Ca和P,这些成分能在很大程度上促进骨成型。在3个月的植入实验中,合金体积中有35%发生了降解,证实了Mg-Ca合金的医用可行性。
Zn是人体重要的微量元素之一,是骨和软骨可选酶的辅助因子,因而Mg-Zn合金是一种具有较大潜力的生物材料。Koc等[21]对比了铸态Mg-xZn在SBF中的电化学降解速率。结果显示,随着Zn含量的增多(0%→0.5%→1%→2%→3%),Mg-Zn合金的降解速率逐渐降低(4.342→3.062→2.833→2.628→2.331 mm/a)。产生此现象的主要原因是Zn元素在Mg-Zn合金中具有细化晶粒的作用,Zn含量的增多使得晶粒细化从而降低了合金的降解速率。Abdel-gawad等[22]在Mg-0.6Ca合金中加入了不同含量的Zn元素,测得其在SBF模拟液中的电化学降解速率。结果显示,添加2%Zn时合金的降解性能最佳,为0.043 mm/a。该现象产生的主要原因是微量Zn的加入细化了晶粒,并且形成了Ca2Mg6Zn3保护层作为保护屏障,从而降低了降解速率。
Zhang等[23]将Mg-6Zn合金和纯镁植入老鼠的膀胱处,2周后取出结果显示:Mg-6Zn合金已降解体积明显高于纯镁,这主要是由于Zn(OH)2膜层的破裂同基体与第二相产生的电偶腐蚀耦合作用的结果。Cihova等[24]对不同Zn含量的挤压态Mg-Zn-Ca合金在幼年大鼠的股骨中进行了植入实验。植入后的Micro-CT显示,与Mg-1.25Zn-0.25Ca合金相比,Mg-1Zn-0.3Ca合金具有更低的降解速率。在植入后的第4周,降解体积分数控制在(5±3)%范围内,在第26周达到了(36±8)%,Mg-1Zn-0.3Ca合金与Mg-1.25Zn-0.25Ca合金在第52周测得的降解速率分别为(0.091±0.032) mm/a和(0.123±0.025) mm/a。组织学分析结果显示两种合金与骨接触良好,无不良反应,证明了镁合金材料在肌肉骨骼疾病治疗中的应用价值。
Mn是一种无毒元素,在体内多种酶系统的激活中起主要作用,另外,在合金元素中加入一定量的Mn能去除有害杂质,并在合金表面形成氧化锰膜,实现提高合金降解抗性的目的。Cho等[25]研究表明微量Mn的添加使得晶粒细化,从而提高了Mg-4Zn-0.5Ca合金的耐蚀性。通过对比Mg-4Zn-0.5Ca-xMn(x=0, 0.4, 0.8)合金的降解形貌,发现含高Mn合金(Mg-4Zn-0.5Ca-0.8Mn)的降解形貌较均匀,具有较高的耐蚀性。由电化学实验测得的降解速率分别为0.202, 0.095 mm/a和0.065 mm/a,产生此现象的原因主要有两方面:一是晶粒的细化降低了微电偶腐蚀,二是Mn的加入可使表面形成MnO和MnO2膜层,膜层的产生可作为镁合金的降解屏障,阻碍了Cl-的进一步侵蚀,从而提高了合金膜层的稳定性。
Xu等[26]将Mg-Zn-Mn合金用作骨移植植入物植入老鼠体内。在植入的第9周,种植体100%固定,无过敏反应,氧化产物膜成分以Ca, O, P等元素为主。在种植体周围发现了新骨的形成,约10%~17%的种植体发生降解。而在第18周时,已有54%的镁合金发生了降解,但Zn, Mn元素仍均匀分布在残余的镁合金、降解层和骨组织中,证实了Mg-Zn-Mn合金的医用价值。
Sr是人体中的一种微量元素,具有促进骨成型和减少骨吸收的作用。Zhao等[27]将不同Sr含量的挤压态Mg-xSr(x=0.5, 1, 1.5, 2.5)合金在Hank’s模拟体液中的降解速率做了对比。实验结果显示随着Sr含量的增加(0.5%→1%→1.5%→2.5%),浸泡降解速率明显升高(0.036→0.038→0.043→0.055 mm/a),电化学实验所测得的降解速率具有相同的变化趋势(0.15→0.165→0.204→0.265 mm/a)。两种降解速率对比表明Sr含量为0.5%时具有最佳的降解抗性。该现象的产生主要与晶粒尺寸有关,当Sr含量为0.5%时,合金中具有较多的细小等轴晶粒,但随着Sr含量的增多,晶粒多变为长条状,从而降低了降解抗性。Cheng等[28]对比了Mg-5Zn-xSr在不同腐蚀环境(0.9%NaCl溶液和Hank’s溶液)中的降解速率。当Sr含量增加时(0%→0.2%→0.3%→1%),合金在两种腐蚀环境下的电化学降解速率都有相同的变化趋势:降低→升高→降低(NaCl溶液中的降解速率:1.005→0.797→0.993→0.944 mm/a,Hank’s溶液中的降解速率:0.772→0.512→0.723→0.608 mm/a)。两种腐蚀环境下对比发现,当加入0.2%Sr时降解速率最低(分别为0.797 mm/a和0.512 mm/a),其主要原因为微量Sr的加入能极大地细化晶粒,提高材料的耐蚀性。且对比Mg-5Zn合金,Sr的快速溶解会导致pH值的升高,从而使得Zn(OH)2析出,其相比Mg(OH)2具有更强的保护作用,并且较高含量的Zn(OH)2和Mg(OH)2能够修复点蚀,延缓降解,其反应如下:
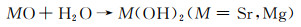
|
(14) |
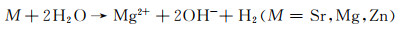
|
(15) |
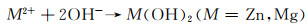
|
(16) |
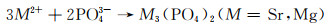
|
(17) |
Pan等[29]对铸态Mg-Zn-Mn-xSr合金在Hank’s溶液中进行了动态降解机制的研究。结果发现,随着Sr含量的不断上升(0.5%→1%→1.5%→3%),在7天时测得的失重速率变化同样具有逐渐上升的趋势(0.115→0.149→0.23→1.006 mm/a)。产生该现象的主要原因在于第二相的变化,SEM结果显示随着Sr含量的增加,合金晶粒尺寸逐渐降低,但第二相体积出现明显升高的趋势,并逐渐由粒子状转变为不连续网状结构。XRD结果表明第二相主要成分为Mg17Sr2。SKPFM结果显示金属间化合物比α-Mg具有更高的电位,导致α-Mg更易在降解过程中作为微观阳极,从而加快电偶腐蚀。
除体外降解外,研究学者同样对Mg-Sr合金进行了体内研究:Gao等[30]对比了纯镁与添加Sr, Ga元素的镁合金在老鼠体内的降解速率,结果表明,纯镁的降解速率明显高于经过合金化处理的镁合金,这主要与表面膜的致密程度有关,经合金化处理的合金表面膜致密程度高,因此具有较高的降解抗性。
Bornapour等[31]将Mg-Sr-Ca合金支架在狗的左右动脉进行了血管植入实验,结果显示:由于Mg-Sr-Ca合金在外层形成了Sr-HA/HA的保护层,且该保护层覆盖于整个合金表面,从而增加了降解抗性,减缓了降解速率。Tie等[32]对Mg-Sr合金以及纯镁在白兔体内进行了植入实验。其降解形貌、降解速率以及XPS分析显示,Mg-Sr合金以均匀降解为主,相比于纯镁具有更低的降解速率,降解层主要由MgO, Mg(OH)2和HA组成,并且在后续的实验过程中发现Sr的稳定持续释放,还可以起到促进骨成型的作用。
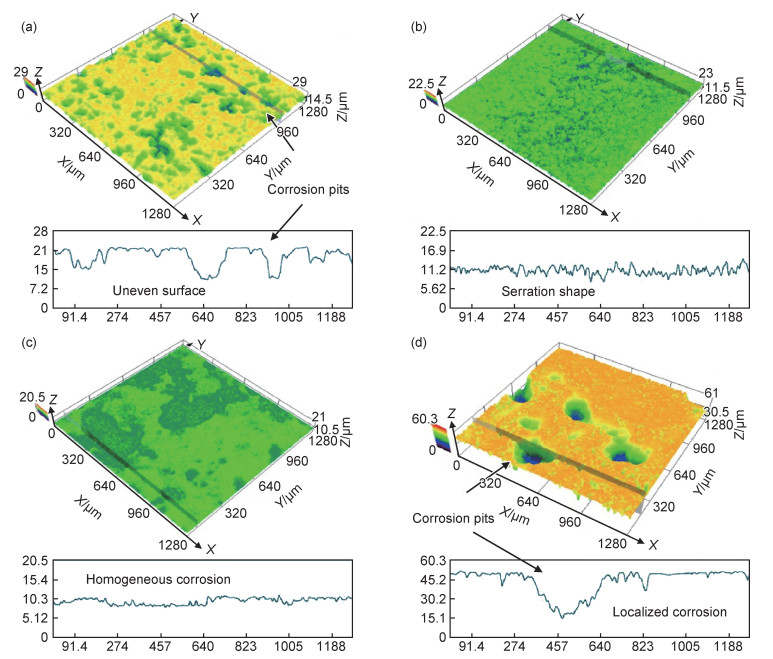
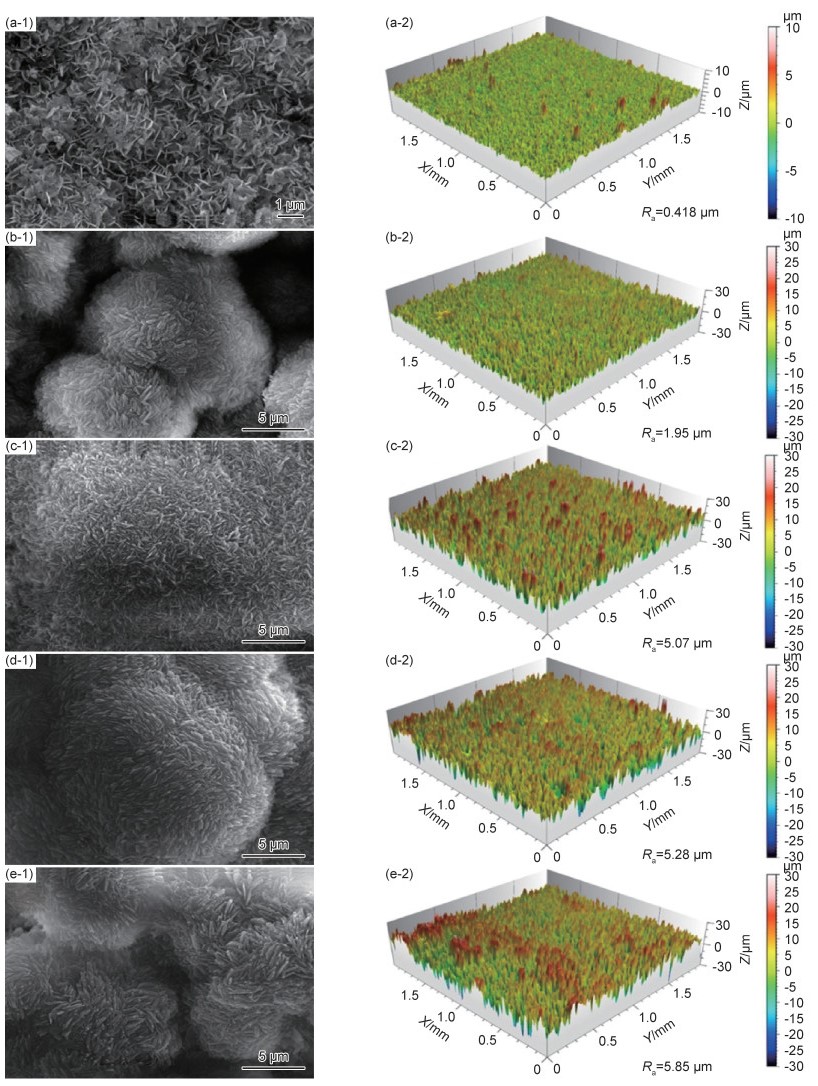
Mg-RE合金凭借其优异的力学性能和降解性能,也逐渐成为目前研究的热点。常见的稀土元素主要包括Y, Nd, Gd等,微量稀土元素的添加可以限制晶粒尺寸,改变析出物形态, 从而起到调控镁合金降解速率的目的[33-34]。其中Nd由于在镁中具有较高的固溶度以及降解产物的无毒性,同时还具有良好的生物相容性,使其作为一种新型生物医用材料得到了人们的重视。本课题组[12]在Kokubo’s模拟液中研究了Mg-Zn-Mn-xNd(MZM-xNd)合金的降解行为。结果显示,随着Nd含量的增加(0%→0.6%→1.2%→1.8%),降解速率出现了先降低后升高的现象(8.43→1.15→2.23→3.82 mm/a)。去除降解产物后,材料的三维降解形貌如图 3所示,其去除降解产物后合金表面的降解坑深度、分布显示,随着Nd含量的增加,合金表面腐蚀坑深度低且分布均匀。但随着Nd含量的进一步增加,合金局部降解严重。产生的原因为:SEM结果显示随着Nd含量的增加,晶粒逐渐细化,然而析出相逐渐增多,导致降解速率的提高。并且微量Nd的添加可以提高表面膜的致密性,如图 4所示,微量Nd的添加使表面膜层更加致密,极大地降低合金的腐蚀敏感性,从而增强合金的降解抗性。此外,经XRD分析,试样表面有HA的产生,其具体反应如下所示:
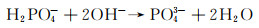
|
(18) |
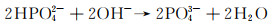
|
(19) |
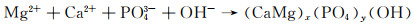
|
(20) |
HA的产生同样可以作为阻碍合金降解的屏障,但随着Nd含量的增加,表面膜会逐渐变得疏松,从而降低了合金的降解抗性。Cai等[35]研究表明添加0.2%~0.6%的Nd能细化合金晶粒,形成CaHPO4·2H2O膜层,增加了降解抗性。但过量Nd的添加会导致第二相晶粒尺寸增大,加速电偶腐蚀。Luo等[11]在3.5%NaCl溶液中测试了Mg-6Gd-2Y-(0→0.5%→1%→1.5%)Nd-0.2Zr合金的降解性能,电化学实验测得的降解速率表明在添加0.5%Nd时合金的降解速率最低(1.819→1.17→2.063→3.921 mm/a),降解抗性最高。而当Nd的含量在1.5%时,合金的降解抗性最低。该现象的产生主要与第二相的体积分数有关,在添加1.5%Nd时第二相析出较多,易发生电偶腐蚀,加快了合金的降解进程。Chen等[36]研究发现在Mg-2Zn-xGd-0.5Zr合金中随着Gd含量的增加(0→0.5%→1%→2%),合金的降解速率先降低后升高(0.25→0.15→0.1→0.28 mm/a)。这主要是由于随着Gd含量的升高,晶粒会逐渐得到细化,第二相析出逐渐增多。当Gd含量较低时,第二相分布较均匀,这些均匀分布的第二相可作为屏障阻碍合金的降解进程,但当Gd含量过高时,会导致大量第二相的析出,从而形成电偶腐蚀,推动降解进程。Liu等[37]研究了在0.1 mol/L的NaCl溶液中Mg-Y合金的降解速率,结果表明:随着Y含量的增加(1%→2%→3%→5%),Mg-Y合金的降解速率呈现上升趋势(0.279→0.411→0.418→0.457 mm/a)。这主要是由于Y含量的增加,生成了富Y区,同时也导致更多的Y元素固溶进入基体,提高了基体的化学活性,从而加速了合金的降解,但是网状的富Y区可产生一定的屏障作用来阻碍降解进程。
Zhang等[38]将挤压态Mg-Nd-Zn-Zr合金支架在兔颈总动脉进行了20个月的植入研究,发现支架在植入白兔颈总动脉20个月后生物安全性良好。Mg, Zn元素可以安全代谢,而Nd和Zr不会在器官特别是大脑中持续积累。整个内皮化过程耗时28天。Mg在JDBM支架中的完全吸收时间约为4个月,降解产物主要为Ca磷酸盐复合物,这些复合物可在25个月内完全降解,消除了在镁合金支架降解过程中可能出现的血管钙化问题。
Lukyanova等[39]将WE43合金植入小鼠体内,皮下植入后,结果显示:WE43合金的生物降解率较低,且无大量氢气的产生。样品表面与周围组织形成亲密接触,未见损伤组织,接触区有新生血管的形成,重要的是,形态学研究表明,在小鼠体内植入WE43合金并没有造成重大的全身损害,在一定程度上证实了镁合金作为医用材料的可行性。
2 热处理工艺热处理也可作为提高镁合金降解抗性的一种有效手段,通过热处理可以在改变晶粒尺寸的同时调控析出物的数量以及形态,从而在一定程度上抑制电偶腐蚀的产生,达到增强降解抗性的效果,其原理主要在于不同合金元素的溶解度会随温度产生变化。
在此基础上,本课题组[40]对比了在不同热处理工艺条件下,Mg-2Zn-0.2Mn-1Ca合金在SBF模拟液中的降解行为。研究表明,随着热处理时间的延长(无→300→360→420→460→500 ℃),SEM结果显示析出物数量不断减少,但晶粒尺寸不断增大。由电化学实验测得的降解速率出现了先降低而后升高的趋势(13.11→11.1→10.6→5.94→8.1→8.83 mm/a),且在420 ℃热处理时具有最佳的抗降解性能。降解速率降低的原因主要有以下3点:一方面,第二相溶解到基体中,提高了基体的腐蚀电位,降解速率下降。另一方面,降解产物成核优先出现在基体与第二相之间,随着第二相的逐渐溶解,微电偶腐蚀明显减弱。此外,表面无缺陷,合金形成的致密膜层可以降低腐蚀敏感性,缓解界面区域间的电流交换。而后降解速率升高的现象表明降解速率受晶粒尺寸以及第二相体积的共同调控作用影响。Janbozorgi等[41]对比了铸态和固溶态Mg-2Zn-1Gd-1Ca合金在SBF中的降解性能,结果显示:当经过500 ℃固溶处理后,浸泡降解速率由9.45 mm/a下降至3.82 mm/a,电化学降解速率由3.09 mm/a下降至1.85 mm/a。固溶处理后降解速率明显降低,这主要源于大量析出物的溶解,从而在一定程度上抑制了电偶腐蚀。Zhong等[10]对挤压前时效(aging prior to extrusion, APE)处理前后的Mg-8Sn-2Zn-0.2Mn合金在3.5%NaCl溶液中的降解性能进行了对比。浸泡实验后合金降解速率由5.88 mm/a降至4.31 mm/a,电化学实验测得的降解速率由0.487 mm/a降至0.315 mm/a。APE处理可明显改善合金的降解性能,其主要原因在于APE处理的合金和未进行APE处理的合金相比,第二相Mg2Sn相较小,且弥散均匀分布,而降解多发生在粗大的Mg2Sn相上,因此,APE处理后合金具有更高的降解抗性。Liu等[42]将Mg-Gd-Zn-Zr铸态及热处理态合金的降解性能进行了对比,发现合金的降解速率主要受基体与第二相之间产生的微电偶腐蚀所影响。根据SKPFM以及高分辨率透射X射线层析成像(HRTXT)结果分析,铸态合金中的共晶相具有最高的局部电位(290 mV)和体积分数(42.8%),因此,在共晶相和Mg基体之间存在显著的微电偶效应。然而,经过T4处理后,铸态合金中的共晶相转变为长周期堆垛有序相(long period stacking ordered, LPSO)。相比于共晶相,LPSO相的局部电势和体积分数减小,分别为243 mV和27%,因此,第二相与Mg基体之间的微电流效应明显减小,经T6处理后,析出物的弥散分布提高了α-Mg基体的电势,从而降低了电势差,减弱了微电偶腐蚀,提高了合金的降解抗性。
在体内方面,Torroni等[43]将铸态和热处理态的WE43合金植入绵羊的头盖骨中,结果显示,与铸态合金相比,热处理态合金表现出更优异的稳定性、更低的降解速率和促成骨性能。基于此,可以推测热处理态合金的性能使其更适合用于断裂部位。
3 变形工艺除了优化镁合金的元素组成以及进行热处理以外,还可以通过塑性变形的方式来提升镁合金的降解性能。塑性变形可以迅速改变析出物的尺寸以及分布方式,同时还可以改变晶粒度,通过抑制电偶腐蚀来调控降解速率。常见的塑性变形工艺主要有挤压、轧制以及锻造。
热挤压作为一种有效方式用来改善镁合金的降解性能,Zhong等[10]发现合金中的部分长条相,在热挤压过程中更容易破碎成颗粒,从而起到降低电偶腐蚀的作用。Zhang等[44]对比了铸态和挤压态的Mg-Y-Zn-Zr合金的降解性能,研究发现,挤压态合金的降解抗性明显高于铸态合金。产生的原因在于,在挤压过程中,Mg12YZn相破碎且弥散分布,阻碍再结晶晶粒的迁移,抑制晶粒的长大,从而提高了降解抗性,降低了降解速率。Xu等[45]对比了不同挤压比对Mg-Y合金在3.5%NaCl溶液中降解性能的影响。结果显示挤压后的合金晶粒明显细化,并随着挤压比的增大,剪切带流动平行线越来越明显,且平行线上分布着大量细小的等轴晶,使合金具有更高的降解抗性。Hou等[46]对比了铸态与挤压态Mg-3Sn-1Zn-0.5Mn合金在SBF中的降解性能。结果表明:电化学测试的降解速率由0.574 mm/a降至0.301 mm/a。产生的主要原因在于在热挤压过程中,Mg-3Sn-1Zn-0.5Mn合金发生完全动态再结晶,组织多为细小的等轴晶,并且对比铸态合金,挤压态合金的第二相并没有明显的增多,因此挤压态合金表现出了更好的降解抗性。Gui等[47]对比了铸态及挤压态Mg-Gd-Zn-Zr-Mn合金在Hank’s溶液中的降解性能。拟合结果表明,挤压合金的Rct明显高于铸态合金。铸态合金第二相在晶界处呈现网状结构,挤压态合金第二相沿挤压方向呈现小的粒子分布。材料的电化学降解速率由0.38 mm/a降至0.34 mm/a,降解形貌显示:铸态合金表面出现大面积降解,挤压态局部点蚀,挤压成型合金的大部分区域得到了很好的保护,并且随着反应活性的增加以及氧化膜在晶粒细化材料表面成核位点的增多,使得挤压态合金可以更快地形成保护层。谢鑫等[48]研究了挤压温度对Mg-Gd-Y-Nd-Zr合金在Hank’s溶液中的降解机制,相比均质化态合金,挤压态合金晶粒尺寸大幅度减小,且随着挤压温度的升高,晶粒度有上升的趋势。析氢实验显示,合金析氢降解速率先降低后升高,450 ℃时具有最低的降解速率。电化学实验结果具有同样的变化趋势(随着温度的升高0→390→420→450→480 ℃,降解速率分别为1.117→0.649→0.596→0.684→0.875 mm/a)。其原因在于低温挤压时组织分布不均匀,细晶与存在的部分粗晶易形成微电偶电池,外加基体与第二相之间的微电偶效应,加剧镁合金降解行为。而温度过高会导致晶粒度过大,同样会加剧合金的微电偶腐蚀进程。
Ding等[6]对挤压态Mg-4Zn-0.2Ca合金在兔子体内进行了动脉手术夹植入实验。结果表明,合金发生了明显的动态降解行为,远离心脏部位的合金降解均匀,降解产物沉积在蜂窝状降解坑中,抑制了进一步的降解。分析其降解所产生的O, Ca, P, Zn, Mg等物质均有益于血管的愈合,证实了镁合金作为植入物的潜在价值。Miao等[49]将纯镁以及挤压态Mg-2Zn-1Gd合金植入小白鼠体内。植入10天后两种合金的降解形貌都较均匀,随着植入时间的延长,可以发现许多严重的点蚀行为出现在两种合金的表面,但与纯镁相比,挤压态Mg-Zn-Gd合金具有更高的降解速率,挤压态Mg-2Zn-1Gd合金的降解速率在第10天为(0.11±0.04) mm/a,在植入30天后降解速率达到了(0.31±0.01) mm/a。降解层主要元素为O和Mg,伴随少量C, P, Ca的存在。降解层较厚,主要由于Zn和Gd元素的加入导致第二相的组成,从而加速了合金的降解。
Cao等[50]对比了在3.5%NaCl溶液中铸态与多向锻造态Mg-4Zn-2Gd-0.5Ca合金的降解速率。相比铸态合金,多向锻造态合金降解抗性得到了明显的改善,并且随着锻造道次的增多(0→1→2→3),降解速率先降低后升高(1.197→0.366→0.37→0.4 mm/a),1次锻造时合金具有最佳的电化学降解性能。降解形貌显示随着锻造次数的增加,降解程度逐渐加重,1次锻造时合金具有最佳的表面形貌。产生这种现象的原因可以认为是位错密度、晶粒尺寸和动态沉淀的综合作用。锻造态合金发生了动态再结晶,且随着锻造道次的增加,再结晶晶粒会逐渐长大。锻造道次的增加也会导致第二相体积分数增大,加速电偶腐蚀,从而起到降低降解抗性的作用。Harandi等[51]对比了不同锻造条件下Mg-1Ca合金的降解速率,研究发现当锻造温度(RT→250→350→450 ℃)升高时,在SBF中测得的电化学降解速率(4.501×10-5→4.341×10-5→8.569×10-5→1.29×10-4 mm/a)呈现先降低后升高的趋势。其产生原因是锻造明显减小了晶粒尺寸,但是温度的升高会导致析出的第二相体积分数增大,使得合金降解速率明显升高。
Nene等[52]发现在300 ℃时对Mg-4Li-1Ca合金进行热轧时,可通过发生动态再结晶细化晶粒尺寸,并且使共晶相(α-Mg+Mg2Ca)分布得更加均匀,从而实现提高降解抗性的要求。Bahmani等[53]发现在螺旋轧制过程中会形成动态再结晶晶粒,并且随着温度的升高这些动态再结晶晶粒会出现逐渐长大的现象。同时伴随着轧制温度的变化,析出物数量也会发生改变,析出物的体积分数会随着轧制温度的升高而降低。实验结果表明,在3.5%NaCl溶液中,300 ℃轧制时的合金具有最低的降解速率,而在过高以及过低温度轧制时降解速率都会偏高。造成这一现象的主要原因是合金降解抗性受晶粒度以及第二相两个方面耦合作用的影响,在300 ℃时析出物过多,第二相体积分数在降解过程中占据主导作用,而在340 ℃时晶粒过大,晶粒度的影响相比于第二相占据主导作用。Han等[54]将轧制态HP-Mg植入兔股骨髁内用作骨折固定,在对轧制态HP-Mg螺钉降解过程分析中显示,该合金在兔股骨髁内骨折固定中降解形态均匀,弯曲力充足,术后4周降解速率为(1.38±0.03) mm/a,螺纹表面沉积磷酸钙以及氧化物。HP-Mg螺钉周围的骨结合良好,在骨折间隙处,骨体积和骨密度增加,术后8周骨折愈合证实了HP-Mg螺钉具有较强的固定能力和促进骨折愈合的作用,因此,HP-Mg作为固定装置在关节内骨折手术中具有巨大的应用潜力。
Gu等[55]将轧制态Mg-2Sr合金植入小鼠体内,在植入4个月之后,其降解速率达到了(1.01 ± 0.07) mm/a,但在骨小梁和皮质区域处仅种植体表面发生了局部降解,而棒的中心仍保持其完整性,且Mg-2Sr合金的植入促进了植入物周围新骨的产生与成型,证实了其临床医用价值。
4 表面改性工艺处理镁合金的降解性能不仅可通过调控晶粒度与第二相来改善,表面改性工艺处理也可作为一种有效方式用来调控镁合金的降解进程。其原理在于通过添加涂层作为物理屏障使镁基体与腐蚀介质分离,从而防止Cl-在镁合金表面缺陷处的形核,实现抑制合金降解的目的。
Kennedy等[56]对比了涂覆等离子体电解氧化(plasma electrolytic oxidation, PEO)涂层前后Mg-7Y-1Zn合金在3.5%NaCl溶液中的耐腐蚀性能。结果显示:电化学降解速率由最初3.54 mm/a降为0.99 mm/a,主要由于表面PEO涂层起着耐蚀层的作用,可防止Mg-7Y-1Zn合金在液体环境中的降解。
Jin等[57]将主要由二氧化锡和少量氧化亚锡组成的氧化膜溅射到生物医用Mg-Y-RE合金上,在SBF溶液中电化学实验测得的降解速率由13.262 mm/a下降至0.038 mm/a。产生此现象的主要原因是涂层合金表面有一层(1.58 ± 0.08) μm厚溅射的表面膜,且基体与膜层之间具有极高的严密性,经改性处理后的镁合金表面被连续致密的膜层所覆盖,产生的薄膜可以作为一个屏障,防止Cl-渗透进入膜层之内并于镁合金表面缺陷处形核,从而最大限度地减少镁基体的破坏。电化学阻抗谱同样显示涂层材料具有更高的阻抗,表明涂层的加入增强了镁合金的耐蚀性能。
Prakash等[58]验证了HA镀层的添加对Mg-Zn-Mn合金在SBF模拟体液降解性能的影响。结果显示,添加涂层的材料降解速率大幅度降低,原因在于HA镀层充当了稳定的阻挡层,从而提高了合金的降解性能。
Kuang等[59]将超疏水涂层电沉积到镁的表面膜层上,并对比了不同沉积时间对镁的表面形貌与在Hank’s溶液中电化学降解速率的影响。结果显示:SEM形貌中(见图 5)含有超疏水涂层的材料被褶皱颗粒覆盖成花状结构(豆蔻酸钙),当沉积时间为5 min时,涂层较薄,且粗糙度为1.95 μm,随着沉积时间的延长(0→5→10→15→20 min),涂层表面的带材颗粒被拉长,表面粗糙度增加到5.85 μm。电化学实验结果显示,随着沉积时间的延长,降解速率出现了先降低后升高的现象(2.057→0.914→0.686→0.457→0.091→0.183 mm/a)。涂覆涂层后的材料降解速率较初始材料有了明显改善,且随着膜层厚度的增大,降解抗性改善得愈加明显,该现象证实了超疏水涂层处理是增强镁合金材料降解抗性的一种重要手段。
Shi等[60]在Mg-Nd-Zn-Zr合金添加了雷帕霉素洗脱聚镀层,电化学实验测得的降解速率由最初的1.4×10-2mm/a降至8.91×10-4mm/a。随后进行了体内植入实验,将涂层合金注入猪的动脉处,冠脉内超声和OCT分析显示无血栓形成且镀层材料降解较慢。在两个月时,支架结构完整,仅部分出现折断,3个月时,虽断裂部位增多,但是支架结构仍保持完整,直径与两个月时相当,表明其具有良好的降解性能。
Wu等[7]进行了有无微弧氧化涂层的镁合金植入物在兔体内外的降解实验。在体外,测得了材料在SBF溶液30 min的降解速率,发现含涂层材料能明显降低合金降解速率,并且随着涂层厚度的增加,材料的降解速率逐渐降低。体外细胞相容性结果显示,微弧氧化涂层可以提高细胞的增殖速度。在植入实验中发现,在植入的第8周,无涂层材料已全部降解,而涂层材料多数维持在体内,降解性能良好,且在种植体周围可以明显地观察到新骨的生成,且损伤骨具有足够的机械强度,这些结果表明微弧氧化涂层镁合金材料具有成为骨移植替代物的潜力。
Li等[9]对比了有无添加MgF2涂层的Mg-Zn-Zr合金在SBF中的降解速率。结果表明,无镀层的合金在开始的3天出现点蚀坑,并失重较大,20天后含涂层的合金表面保持完整,而无镀层材料出现了大量降解的现象,30天后镀层材料仍可见螺纹,无镀层材料完全降解。随后将两种合金植入兔子股骨髁部进行植入实验,结果显示:含镀层的材料降解速率较低,主要是由于镀层被新生骨组织与钙镁磷酸盐层覆盖,从而提高了基体的降解抗性。Jiang等[61]将被MgF2包裹的Mg-Zn-Zr合金植入兔子体内,结果显示:MgF2涂层能有效降低Mg-Zn-Zr合金在体内的降解速率,并且随着涂层的降解,可促进周围新骨的形成,具有较高的医用潜力。
Kim等[62]为提高镁合金的降解性能以及增强其生物相容性,将不同浓度(20, 50, 100 ng/mL分别记为ALB20, ALB50和ALB100)的BMP-2(成骨蛋白)固定到镁合金表面(微弧氧化(MAO)+水热处理所形成的载体层中),并在老鼠胫骨进行了2~4周的体内植入实验。大鼠胫骨植入2周和4周后的组织学分析显示:种植2周后,在骨髓和经表面处理的种植体之间发现有新骨层的形成;植入4周后,骨髓及骨结构细胞愈合,且种植期间,经表面处理的种植体未见炎症细胞,但相比其他浓度下,ALB50组形成的新骨层更为均匀。根据生物可降解植入物植入大鼠胫骨2周和4周后3D形态与体积变化的分析,发现合金在种植2周后,各组种植体体积均较种植前减少(11.56 mm3),且随着BMP-2浓度的增加,降解体积进一步减小。与其他组相比,ALB100组的样本降解体积最低。此外,在3D图像观察到的退化形貌图像中,除ALB20和ALB50基团外,大多数基团都表现出局部降解。结果表明,在LBL载体层(MAO涂层+水热处理)上固定化BMP-2可以延缓镁合金在体内的降解速率,通过持续释放BMP-2,可促进骨形成,而成骨细胞的分化和骨成型的促进程度取决于BMP-2涂层浓度。但是,考虑到合金的综合性能,ALB50组由于降解速率最低,形成的新骨层最均匀,是应用于骨科和种植牙的最理想的表面处理。
5 结束语医用可降解镁合金是目前所研究的最关键的生物材料之一,其降解性能的改善对其在临床行业的应用具有显著的现实意义。本文综述了微合金化、热处理、变形工艺以及表面改性处理4种用来改善镁合金降解性能的方式。但是,镁合金作为人体植入物,其在人体内往往处在比较复杂的受力状态,镁合金的其他性能(包括抗腐蚀疲劳性、生物相容性、腐蚀产物无毒性以及力学性能等)也应得到充分的考量,因此,为了挖掘镁合金体内的发展潜力,可以从以下方面入手:
(1) 进一步强化合金化理论研究,通过建立不同微合金化镁合金与降解速率、降解形貌之间的数据模型,探究不同微合金化处理所产生的第二相及晶粒结构对镁合金降解机制的影响,通过大数据对比,开发新型镁合金。
(2) 开发新型多功能镀层,应考虑涂层的渗透性、附着性以及降解性,在保护基体的前提下,镀层在降解过程中无害并易被人体吸收。
(3) 深度探究镁合金基体与改性层界面、改性层与生物体界面之间的相互作用机制,揭示缓释膜对镁合金降解与活性的影响规律,以及生物活性与腐蚀降解性能之间的内在联系。
(4) 过去镁合金的体外研究关注的是在理想、简化下的降解行为,当前虽把研究重点调整到了SBF中,但实验需要在更接近人体环境中的条件下进行降解行为的观察,Hank’s, SBF等腐蚀介质虽富含细胞,蛋白质和酶等人体体液环境所含有的复杂因子,但都无法准确反映镁合金在人体内的降解环境,需设定动态环境来更好地模拟镁合金的降解行为。
(5) 采用新的高分辨率仪器在线监测镁合金体内降解过程及其与生物系统之间的相互作用,是促进生物降解镁合金研究的突破型工具,但目前实时监测仍是一个技术瓶颈,无法为降解产物与周围组织之间的相互作用提供有力证据,可结合先进的传感技术、移动应用和大数据分析,建立新的监测途径解决这一关键问题。
| [1] |
AGARWAL S, CURTIN J, DUFFY B, et al. Biodegradable magnesium alloys for orthopaedic applications: a review on corrosion, biocompatibility and surface modifications[J]. Materials Science and Engineering: C, 2016, 68(1): 948-963. |
| [2] |
万天, 宋述鹏, 王今朝, 等. 生物医用镁合金腐蚀行为的研究进展[J]. 材料工程, 2020, 48(1): 19-26. WAN T, SONG S P, WANG J Z, et al. Research progress in corrosion behavior of biomedical magnesium alloys[J]. Journal of Materials Engineering, 2020, 48(1): 19-26. |
| [3] |
YANG Y W, HE C X, E D Y, et al. Mg bone implant: features, developments and perspectives[J]. Materials & Design, 2020, 185: 108259. |
| [4] |
LI J L, QIN L, YANG K, et al. Materials evolution of bone plates for internal fixation of bone fractures: a review[J]. Journal of Materials Science and Technology, 2020, 36: 190-208. DOI:10.1016/j.jmst.2019.07.024 |
| [5] |
ALI M, HUSSEIN M A, AL-AQQELI N. Magnesium-based composites and alloys for medical applications: a review of mechanical and corrosion properties[J]. Journal of Alloys and Compounds, 2019, 792: 1162-1190. DOI:10.1016/j.jallcom.2019.04.080 |
| [6] |
DING P F, LIU Y C, HE X H, et al. In vitro and vivo biocompatibility of Mg-Zn-Ca alloy operative clip[J]. Bioactive Materials, 2019, 4: 236-244. DOI:10.1016/j.bioactmat.2019.07.002 |
| [7] |
WU Y F, WANG Y M, ZHAO D W, et al. In vivo study of micro-arc oxidation coated Mg alloy as a substitute for bone defect repairing: degradation behavior, mechanical properties, and bone respone[J]. Colloids and Surfaces B: Biointerfaces, 2019, 181(1): 349-359. |
| [8] |
WANG H X, GUAN S K, WANG Y S, et al. In vivo degradation behavior of Ca-deficient hydroxyapatite coated Mg-Zn-Ca alloy for bone implant application[J]. Colloids and Surfaces B: Biointerfaces, 2011, 88(1): 254-259. DOI:10.1016/j.colsurfb.2011.06.040 |
| [9] |
LI Z, SUN S Z, CHEN M F, et al. In vitro and in vivo corrosion, mechanical properties and biocompatibility evaluation of MgF2-coated Mg-Zn-Zr alloy as cancellous screws[J]. Materials Science and Engineering: C, 2017, 75: 1268-1280. DOI:10.1016/j.msec.2017.02.168 |
| [10] |
ZHONG L P, WANG Y J, LUO H, et al. Influence of aging prior to extrusion on the microstructure and corrosion resistance of Mg-8Sn-2Zn-0.2Mn alloy[J]. Journal of Alloys and Compounds, 2019, 780: 783-791. DOI:10.1016/j.jallcom.2018.11.400 |
| [11] |
LUO Y F, DENG Y L, GUAN L Q, et al. The microstructure and corrosion resistance of as extruded Mg-6Gd-2Y-(0-1.5) Nd-0.2Zr alloys[J]. Materials & Design, 2020, 186: 108289. |
| [12] |
ZHANG Y, LI J X, LI J Y. Microstructure, mechanical properties, corrosion behavior and film formation mechanism of Mg-Zn-Mn-xNd in Kokubo's solution[J]. Journal of Alloys and Compounds, 2018, 730: 458-470. DOI:10.1016/j.jallcom.2017.09.325 |
| [13] |
ZHANG Y, LI J Y, LIAW P K, et al. Effects of heat treatment on the mechanical properties and corrosion behaviour of the Mg-2Zn-0.2Mn-xNd alloys[J]. Journal of Alloys and Compounds, 2018, 769: 552-565. DOI:10.1016/j.jallcom.2018.07.359 |
| [14] |
ZHANG Y, LI J X, LI J Y, et al. Effect of calcium addition on phase characteristics and corrosion behaviors of Mg-2Zn-0.2Mn-xCa in simulated body fluid[J]. Journal of Alloys and Compounds, 2017, 728: 37-46. DOI:10.1016/j.jallcom.2017.08.264 |
| [15] |
LI J X, ZHANG Y, LI J Y, et al. Effect of trace HA on microstructure, mechanical properties and corrosion behavior of Mg-2Zn-0.5Sr alloy[J]. Journal of Materials Science and Technology, 2017, 34(2): 299-310. |
| [16] |
JEONG Y S, KIM W J. Enhancement of mechanical properties and corrosion resistance of Mg-Ca alloys through microstructure refinement by indirect extrusion[J]. Corrosion Science, 2014, 82: 392-403. DOI:10.1016/j.corsci.2014.01.041 |
| [17] |
MOHAMED A, EL-AZIZ A M, BREITINGER H G. Study of the degradation behavior and the biocompatibility of Mg-0.8Ca alloy for orthopedic implant applications[J]. Journal of Magnesium and Alloys, 2019, 7(2): 249-257. DOI:10.1016/j.jma.2019.02.007 |
| [18] |
LIU Y H, CHENG W L, ZHANG Y, et al. Microstructure, tensile properties, and corrosion resistance of extruded Mg-1Bi-1Zn alloy: the influence of minor Ca addition[J]. Journal of Alloys and Compounds, 2020, 815: 152414. DOI:10.1016/j.jallcom.2019.152414 |
| [19] |
王勇, 周红, 乔丽英, 等. Ca含量对ZM61组织及模拟体液中腐蚀行为的影响[J]. 材料工程, 2013(6): 87-91. WANG Y, ZHOU H, QIAO L Y, et al. Effect of Ca content on microstructure and corrosion performance in SBF of ZM61 alloy[J]. Journal of Materials Engineering, 2013(6): 87-91. DOI:10.3969/j.issn.1001-4381.2013.06.018 |
| [20] |
XIA Y H, ZHANG B P, WANG Y, et al. In vitro cytotoxicity and in vivo biocompatibility of as extruded Mg-4.0Zn-0.2Ca alloy[J]. Materials Science and Engineering: C, 2012, 32(4): 665-669. DOI:10.1016/j.msec.2012.01.004 |
| [21] |
KOC E, KANNAN M B, UNAL M, et al. Influence of zinc on the microstructure, mechanical properties and in vitro corrosion behavior of magnesium-zinc binary alloys[J]. Journal of Alloys and Compounds, 2015, 648(5): 291-296. |
| [22] |
ABDEL-GAWAD S A, SHOEIB M A. Corrosion studies and microstructure of Mg-Zn-Ca alloys for biomedical applications[J]. Surface and Interfaces, 2019, 14: 108-116. DOI:10.1016/j.surfin.2018.11.011 |
| [23] |
ZHANG S Y, ZHENG Y, ZHANG L M, et al. In vitro and in vivo corrosion and histocompatibility of pure Mg and a Mg-6Zn alloy as urinary implants in rat model[J]. Materials Science and Engineering: C, 2016, 68(1): 414-422. |
| [24] |
CIHOVA M, MARTINELLI E, SCHMUTZ P, et al. The role of zinc in the bio-corrosion behavior of resorbable of Mg-Zn-Ca alloys[J]. Acta Biomaterialia, 2019, 100: 398-414. DOI:10.1016/j.actbio.2019.09.021 |
| [25] |
CHO D H, LEE B M, PARK J Y, et al. Effect of Mn addition on corrosion properties of biodegradable Mg-4Zn-0.5Ca-xMn alloy[J]. Journal of Alloys and Compounds, 2017, 695: 1166-1174. DOI:10.1016/j.jallcom.2016.10.244 |
| [26] |
XU L P, YU G N, ZHANG E L, et al. In vivo corrosion behavior of Mg-Mn-Zn alloy for bone implant application[J]. Journal of Biomedical Materials Research Part A, 2007, 83(3): 703-711. |
| [27] |
ZHAO C Y, PAN F S, ZHANG L, et al. Microstructure, mechanical properties, bio-corrosion properties and cytotoxicity of as extruded Mg-Sr alloy[J]. Materials Science and Engineering: C, 2017, 70(2): 1081-1088. |
| [28] |
CHENG M X, CHEN J H, YAN H G, et al. Effects of minor Sr addition on microstructure, mechanical and bio-corrosion properties of the Mg-5Zn based alloy system[J]. Journal of Alloys and Compounds, 2017, 691: 95-102. DOI:10.1016/j.jallcom.2016.08.164 |
| [29] |
PAN H, PANG K, GUI F Z, et al. Effect of alloyed Sr on the microstructure and corrosion behavior of biodegradable Mg-Zn-Mn alloy in Hank's solution[J]. Corrosion Science, 2019, 157: 420-437. DOI:10.1016/j.corsci.2019.06.022 |
| [30] |
GAO Z H, SONG M S, LIU R L, et al. Improving in vitro and in vivo antibacterial functionality of Mg alloys through micro-alloying with Sr and Ga[J]. Materials Science and Engineering: C, 2019, 104: 109926. DOI:10.1016/j.msec.2019.109926 |
| [31] |
BORNAPOUR M, MAHJOUBI H, VALI H, et al. Surface characterization, in vitro and in vivo biocompatibility of Mg-0.3Sr-0.3Ca for temporary cardiovascular implant[J]. Materials Science and Engineering: C, 2016, 67: 72-84. DOI:10.1016/j.msec.2016.04.108 |
| [32] |
TIE D, GUAN R G, LIU H N, et al. An in vivo study on the metabolism and osteogenic activity of bioabsorbable Mg-1Sr alloy[J]. Acta Biomaterialia, 2016, 29: 455-467. DOI:10.1016/j.actbio.2015.11.014 |
| [33] |
刘军, 张金玲, 渠治波, 等. 稀土Gd对AZ31镁合金耐蚀性能的影响[J]. 材料工程, 2018, 46(6): 73-79. LIU J, ZHANG J L, QU Z B, et al. Effect of rare earth Gd on corrosion resistance of AZ31 magnesium alloy[J]. Journal of Materials Engineering, 2018, 46(6): 73-79. |
| [34] |
赵曦, 贾瑞灵, 周伟光, 等. 稀土对AZ91镁合金干/湿循环腐蚀产物及阻抗行为的影响[J]. 材料工程, 2017, 45(4): 41-50. ZHAO X, JIA R L, ZHOU W G, et al. Effect of rare earth on corrosion products and impedance behavior of AZ91 magnesium alloy under dry-wet cycles[J]. Journal of Materials Engineering, 2017, 45(4): 41-50. |
| [35] |
CAI C H, SONG R B, WANG L X, et al. Surface corrosion behavior and reaction product film deposition mechanism of Mg-Zn-Zr-Nd alloys during degradation process in Hank's solution[J]. Surface and Coatings Technology, 2018, 342: 57-68. DOI:10.1016/j.surfcoat.2018.02.085 |
| [36] |
CHEN J X, TAN L L, YU X M, et al. Effect of minor content of Gd on the mechanical and degradable properties of as cast Mg-2Zn-xNd-0.5Zr alloys[J]. Journal of Materials Science and Technology, 2019, 35(4): 503-511. DOI:10.1016/j.jmst.2018.10.022 |
| [37] |
LIU X B, SHAN D Y, SONG Y W, et al. Influence of yttrium element on the corrosion behaviors of Mg-Y binary magnesium alloy[J]. Journal of Magnesium and Alloys, 2017, 5(1): 26-34. DOI:10.1016/j.jma.2016.12.002 |
| [38] |
ZHANG J, LI H Y, WANG W, et al. The degradation and transport mechanism of a Mg-Nd-Zn-Zr stent in rabbit common carotid artery: a 20-month study[J]. Acta Biomaterialia, 2018, 69: 372-384. DOI:10.1016/j.actbio.2018.01.018 |
| [39] |
LUKYANOVA E, ANISIMOVA N, MARTYNENKO N, et al. Features of in vitro and in vivo behaviour of magnesium alloy WE43[J]. Materials Letters, 2018, 215: 308-311. DOI:10.1016/j.matlet.2017.12.125 |
| [40] |
ZHANG Y, LI J X, LI J Y. Effects of microstructure transformation on mechanical properties, corrosion behaviors of Mg-Zn-Mn-Ca alloys in simulated body fluid[J]. Journal of the Mechanical Behavior of Biomedical Materials, 2018, 80: 246-257. DOI:10.1016/j.jmbbm.2018.01.028 |
| [41] |
JANBOZORGI M, TAHERI K K, TAHERI A K. Microstructural evolution, mechanical properties, and corrosion resistance of a heat-treated Mg alloy for the bio-medical application[J]. Journal of Magnesium and Alloys, 2019, 7(1): 80-89. DOI:10.1016/j.jma.2018.11.002 |
| [42] |
LIU J, YANG L X, ZHANG C Y, et al. Significantly improved corrosion resistance of Mg-15Gd-2Zn-0.39Zr alloys: effect of heat-treatment[J]. Journal of Materials Science and Technology, 2019, 35(8): 1644-1654. DOI:10.1016/j.jmst.2019.03.027 |
| [43] |
TORRONI A, XIANG C C, WITEK L, et al. Biocompatibility and degradation properties of WE43 Mg alloy with and without heat treatment: in vivo evaluation and comparison in a cranial bone sheep model[J]. Journal of Cranio-Maxillofacial Surgery, 2017, 45(12): 2075-2083. DOI:10.1016/j.jcms.2017.09.016 |
| [44] |
ZHANG Z Q, LIU X, HU W Y, et al. Microstructures, mechanical properties and corrosion behaviors of Mg-Y-Zn-Zr alloys with specific Y/Zn mole ratios[J]. Journal of Alloys and Compounds, 2015, 624: 116-125. DOI:10.1016/j.jallcom.2014.10.177 |
| [45] |
XU H, ZHANG X, ZHANG K, et al. Effect of extrusion on corrosion behavior and corrosion mechanism of Mg-Y alloy[J]. Journal of Rare Earths, 2016, 34: 315-327. DOI:10.1016/S1002-0721(16)60031-5 |
| [46] |
HOU L D, LI Z, ZHAO H, et al. Microstructure, mechanical properties, corrosion behavior and biocompatibility of as extruded biodegradable Mg-3Sn-1Zn-0.5Mn alloy[J]. Journal of Materials Science and Technology, 2016, 32(9): 874-882. DOI:10.1016/j.jmst.2016.07.004 |
| [47] |
GUI Z Z, KANG Z X, LI Y Y. Corrosion mechanism of the as cast and as extruded biodegradable Mg-3.0Gd-2.7Zn-0.4Zr-0.1Mn alloys[J]. Materials Science and Engineering: C, 2019, 96: 831-840. DOI:10.1016/j.msec.2018.11.037 |
| [48] |
谢鑫, 唐建国, 石洪吉, 等. 挤压温度对Mg-5.3Gd-2.6Y-1.1Nd-0.3Zr合金的力学性能和耐生物腐蚀性能的影响[J]. 材料工程, 2019, 47(10): 76-81. XIE X, TANG J G, SHI H J, et al. Effect of extrusion temperature on mechanical properties and biological corrosion resistance of Mg-5.3Gd-2.6Y-1.1Nd-0.3Zr alloy[J]. Journal of Materials Engineering, 2019, 47(10): 76-81. DOI:10.11868/j.issn.1001-4381.2017.001426 |
| [49] |
MIAO H W, ZHANG D D, CHEN C X, et al. Research on biodegradable Mg-Zn-Gd alloys for potential orthopedic implants: in vitro and in vivo evaluations[J]. ACS Biomaterials Science and Engineering, 2019, 5(3): 1623-1634. DOI:10.1021/acsbiomaterials.8b01563 |
| [50] |
CAO F F, DENG K K, NIE K B, et al. Microstructure and corrosion properties of Mg-4Zn-2Gd-0.5Ca alloy influenced by multidirectional forging[J]. Journal of Alloys and Compounds, 2019, 770: 1208-1220. DOI:10.1016/j.jallcom.2018.08.191 |
| [51] |
HARANDI S E, IDRIS M H, JAFARI H. Effect of forging process on microstructure, mechanical and corrosion properties of biodegradable Mg-1Ca alloy[J]. Materials & Design, 2011, 32(5): 2596-2603. |
| [52] |
NENE S S, KASHYAP B P, PRABHU N, et al. Microstructure refinement and its effect on specific strength and bio-corrosion resistance in ultralight Mg-4Li-1Ca (LC41) alloy by hot rolling[J]. Journal of Alloys and Compounds, 2014, 615: 501-506. DOI:10.1016/j.jallcom.2014.06.151 |
| [53] |
BAHMANI A, ARTHANARI S, SHIN K S. Improvement of corrosion resistance and mechanical properties of a magnesium alloy using screw rolling[J]. Journal of Alloys and Compounds, 2020, 813: 152155. DOI:10.1016/j.jallcom.2019.152155 |
| [54] |
HAN P, CHENG P F, ZHANG S X, et al. In vitro and in vivo studies on the degradation of high-purity Mg (99.99 wt.%) screw with femoral intracondylar fractured rabbit model[J]. Biomaterials, 2015, 64: 57-69. DOI:10.1016/j.biomaterials.2015.06.031 |
| [55] |
GU X N, XIE X H, LI N, et al. In vitro and in vivo studies on a Mg-Sr binary alloy system developed as a new kind of biodegradable metal[J]. Acta Biomaterialia, 2012, 8(6): 2360-2374. DOI:10.1016/j.actbio.2012.02.018 |
| [56] |
KENNEDY E, SHIVAPPA, SRIRAMAN, et al. Influence of PEO coatings on mechanical and corrosion properties of Mg-7Y-1Zn alloy[J]. Materialstoday: Proceedings, 2020, 27(3): 2236-2238. |
| [57] |
JIN W H, WANG G M, QASIM A M, et al. Corrosion protection and enhanced biocompatibility of biomedical Mg-Y-RE alloy coated with tin dioxide[J]. Surface and Coatings Technology, 2019, 375: 78-82. |
| [58] |
PRAKASH C, SINGH S, PABLA B S, et al. Synthesis, characterization, corrosion and bioactivity investigation of nano-HA coating deposited on biodegradable Mg-Zn-Mn alloy[J]. Surface and Coatings Technology, 2018, 346: 9-18. DOI:10.1016/j.surfcoat.2018.04.035 |
| [59] |
KUANG J, BA Z X, LI Z Z, et al. The study on corrosion resistance of superhydrophobic coatings on magnesium[J]. Applied Surface Science, 2020, 501: 144137. DOI:10.1016/j.apsusc.2019.144137 |
| [60] |
SHI Y J, ZHANG L, CHEN J H, et al. In vitro and in vivo degradation of rapamycin-eluting Mg-Nd-Zn-Zr alloy stents in porcine coronary arteries[J]. Materials Science and Engineering: C, 2017, 80: 1-6. DOI:10.1016/j.msec.2017.05.124 |
| [61] |
JIANG H F, WANG J B, CHEN M F, et al. Biological activity evaluation of magnesium fluoride coated Mg-Zn-Zr alloy in vivo[J]. Materials Science and Engineering: C, 2017, 75: 1068-1074. DOI:10.1016/j.msec.2017.03.019 |
| [62] |
KIM S Y, KIM Y K, KIM K S, et al. Enhancement of bone formation on LBL-coated Mg alloy depending on the different concentration of BMP-2[J]. Colloids and Surfaces B: Biointerfaces, 2019, 173: 437-446. DOI:10.1016/j.colsurfb.2018.09.061 |
 2021, Vol. 49
2021, Vol. 49