文章信息
- 刘伟明, 李久勇, 张晓锋, 马一博, 韦友秀, 张旋, 颜悦
- LIU Wei-ming, LI Jiu-yong, ZHANG Xiao-feng, MA Yi-bo, WEI You-xiu, ZHANG Xuan, YAN Yue
- Li7P2S8I固态电解质的湿化学法制备及性能
- Preparation and properties of Li7P2S8I solid electrolyte by wet-chemical method
- 材料工程, 2021, 49(4): 159-166
- Journal of Materials Engineering, 2021, 49(4): 159-166.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2020.000126
-
文章历史
- 收稿日期: 2020-02-18
- 修订日期: 2020-06-24
2. 北京市先进运载系统结构透明件工程技术研究中心, 北京 100095;
3. 河南科技大学 材料科学与工程学院, 河南 洛阳 471000
2. Beijing Engineering Research Center of Advanced Structural Transparence for the Modern Traffic System, Beijing 100095, China;
3. School of Materials Science and Engineering, Henan University of Science and Technology, Luoyang 471000, Henan, China
全固态锂电池以其在安全性、循环寿命和比能量密度等方面的突出潜力优势,成为下一代二次电源的重要发展方向之一。无机固态电解质作为其中重要的组成部分,需要具备宽电化学窗口、高离子电导率以及与金属锂良好的电化学稳定性和化学相容性。无机固态电解质主要包括氧化物和硫化物两大类型材料。其中氧化物陶瓷电解质的化学和电化学稳定性优异,且具有良好的离子导电性(10-3 S·cm-1),但该类电解质脆性高,难以满足大容量固态电池应用需求[1]。相比氧化物类电解质,硫系固态电解质不需要高温陶瓷化烧结,具有优异的机械加工性能和离子电导率,除了作为电解质,也可以添加到固态电池正极提高离子传导速率,因而该类电解质在固态锂电池方面具有良好的应用前景[2-3]。
Li2S-P2S5二元体系是硫系固态电解质中研究最多的体系之一,该体系具有优异的电化学性能,例如75Li2S·25P2S5(Li3PS4)固态电解质离子电导率为1.6×10-4 S·cm-1,在80 ℃条件下与金属锂依然具有出色的电化学相容性[4-5]。经过压片热处理的70Li2S·30P2S5(Li7P3S11)玻璃陶瓷的室温离子电导率更是高达1.7×10-2 S·cm-1,与液体电解质水平相接近[6]。除单纯的Li2S-P2S5体系以外,研究人员还将卤化锂盐引入Li2S-P2S5形成新的复合体系进而提高电解质性能,例如在硫系电解质中加入LiI可进一步提高其离子电导率和电化学稳定性[7-9]。研究结果表明LiI-Li2S-P2S5电解质在生成的固态电解质界面(SEI)中存在离子电导率高且电子绝缘的LiI[10],从而提高锂离子在锂-电解质界面的迁移率[11-12],抑制锂枝晶的生长[13]。Rangasamy等通过β-Li3PS4和LiI的反应制备了新的晶体Li7P2S8I,与β-Li3PS4母体结构相比,这种电解质离子电导率提高400%,而且与金属锂的稳定性也得到显著增强[8]。
硫系固态电解质的制备方式通常采用机械球磨法或熔融淬火法,这些传统的制备方法虽然有助于新型材料开发,但由于存在能耗高、耗时长、工艺成本高等缺点而不适用于大规模工业化生产。近年来,以有机溶剂为反应介质的湿化学法由于具有工艺简洁、成本经济、可调控性强等优势,受到众多关注[5, 14-17]。对于湿化学法制备硫系电解质,反应溶剂类型的选择对电解质纯度和电化学性质有重要影响。本工作所选溶剂四氢呋喃是一种中等极性的非质子溶剂,可与中间产物β-Li3PS4形成中等结合强度的共沉淀结合物,同时该溶剂沸点较低有助于从反应生成的溶剂合物中脱除,相比碳酸二甲酯、甲基丙基酮等溶剂,其制备产物具有溶剂残留量低和电化学性质较好的优势[18-20]。基于以上分析,本工作采用四氢呋喃作为反应介质,通过湿化学法及后续真空热反应制备Li7P2S8I固态电解质,并对其微观结构和电化学性能进行表征、测试和分析。
1 实验材料与方法 1.1 实验过程在手套箱内(O2含量 < 1×10-7,H2O含量 < 1×10-7),将P2S5(分析纯,含P量≥24.0%(质量分数),国药化学试剂)和Li2S(纯度≥99.9%,Alfa Aesar)粉末按照摩尔比3∶1在研钵中直接混合并研磨均匀,之后转移至有一定体积四氢呋喃(tetrahydrofuran,THF,纯度≥99.5%,分子筛额外干燥,含水量≤50×10-6,安耐吉化学)的锥形瓶中,使用磁力搅拌器以1000 r/min转速搅拌反应20 h,反应结束后转移至离心管,以5000 r/min转速离心处理5 min,之后倒出上层浅黄色清液,加入THF溶剂清洗并再次离心,重复操作3次,直至上层清液澄清透明,倒出上层清液,底部沉淀物即为含有THF的Li3PS4前驱体。
按照2Li3PS4∶1LiI的摩尔比,取棒状LiI(纯度99.9%, 阿拉丁试剂)颗粒研磨至粉末状,加入少量THF,待LiI完全溶解后一起加入Li3PS4·xTHF前驱体中,使用磁力搅拌器以600 r/min转速混合搅拌30 min。室温下使用真空泵初步抽除混合物中的过量溶剂,将真空干燥后的样品研磨成粉末,然后抽真空并逐步升温,去除样品中以溶剂合物形式存在的THF分子,在80,90,100,120 ℃和140 ℃条件下依次保温10 min。取5份经上述过程干燥后所得样品,分别在140,170,200,230 ℃和260 ℃下进行1 h真空结晶热处理,热处理结束后自然冷却得到最终产物。以上全部制备过程均在惰性气氛保护环境中进行。
1.2 表征测试所有样品在测试前均保存在手套箱内,并密封在自制的容器中以避免环境中水氧因素影响。通过STA 499 F3型同步热分析仪(TGA-DSC)来研究粉末样品溶剂脱除及反应的温度范围并以此指导实验过程。使用SU-8010型冷场发射扫描电子显微镜(SEM)及能谱仪(EDS)进行样品形貌及元素分析。利用JY HR-800型显微激光拉曼光谱仪(Raman)和D8 Advance型X射线衍射仪(XRD)进行样品物相结构表征及分析,其中辐射光源为CuKα(λ=0.154178 nm),管电压40 kV,管电流40 mA。
利用BJ-24型压片机和自制绝缘树脂模具对粉末样品进行冷压制片和辅助电化学测试,制片样品质量约为100 mg,选择压强为499 MPa,压制后的圆片样品尺寸为ϕ10 mm×0.70 mm。电化学测试仪器为CHI650e型电化学工作站,频率范围为1~106 Hz,阻塞电极为不锈钢(SUS)柱。利用不同温度下测量的电化学阻抗谱(EIS)计算固态电解质(SE)的活化能,测试温度范围为25~75 ℃(阻抗测试之前样品在目标温度下保温1 h)。组装Li/SE/Li对称电池,采用CT2001A型LAND电池测试系统对电池进行直流极化测试,电流密度为0.1 mA·cm-2,每个充放电循环时间为2 h。对SUS/SE/SUS和Li/SE/Li对称电池施加1 V的恒定电压,根据响应电流值进行电解质中锂离子迁移数计算。通过测试Li/SE/Au电池的循环伏安(CV)曲线来测定电解质样品的电化学窗口,扫描速率为5 mV·s-1,测试电压范围为-0.5~5 V,其中工作电极为镀金(厚约300 nm)铝箔。
2 结果与分析 2.1 反应原理以Li2S,P2S5和LiI为原材料,THF为反应溶剂进行Li7P2S8I固态电解质的制备。整个制备过程分为两步,包括Li3PS4·xTHF前驱体的制备和Li7P2S8I电解质的制备。原理如下:
(1) 在振荡或搅拌的条件下,Li2S首先与极性溶剂THF形成氢键,然后在溶剂的辅助下与P2S5充分反应,生成Li3PS4·xTHF前驱体:

|
(1) |
(2) 溶解在THF中的LiI与Li3PS4·xTHF前驱体均匀混合,在加热脱除混合物中的溶剂分子后进行热处理,最终反应生成结晶态的Li7P2S8I:

|
(2) |
反应及产物转移过程需要严格隔绝空气, 因为Li2S和P2S5对空气中的微量水敏感, 会发生如下副反应[21]:
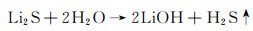
|
(3) |
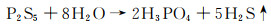
|
(4) |
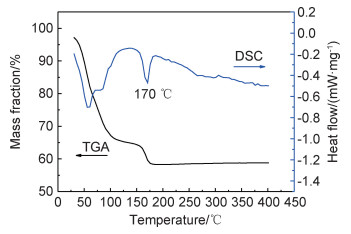
图 1为经过室温真空干燥后粉末样品的TGA-DSC曲线。从DSC曲线可以观察到,从室温到120 ℃温度区间内,有3个连续不规则的吸热峰,对应TGA曲线中35%的质量损失,根据前文同步热分析结果[14],可以判断此为Li3PS4·xTHF中THF分子的去除。此外,在170 ℃有一处明显的吸热峰,对应TGA曲线中7%的质量降低,表明在此温度下有吸热反应发生,同时伴随着气体的释放。两次热重损失比例为5∶1,结合前文实验结果[14]可以得出该物质组成比例约为2Li3PS4·2.5THF+LiI·THF,即170 ℃吸热峰对应于LiI·THF分解。
|
图 1 室温干燥后粉末样品的TGA-DSC曲线 Fig. 1 TGA-DSC curves of powder samples dried at room temperature |
为了确定目标电解质的最佳热处理温度,对真空干燥后的样品分别在140,170,200,230 ℃和260 ℃条件下真空热处理1 h。图 2为上述不同热处理温度相应样品的冷压圆片实物图,圆片直径均为10 mm。经过不同温度真空热处理后,样品的颜色发生了明显的变化。140 ℃加热后,样品为淡黄色,加热温度为170 ℃时,颜色明显加深,成为红褐色,继续升高到200 ℃后,颜色加深至黑褐色,230 ℃和260 ℃加热后的样品颜色基本相同,为灰棕色。由于样品外观颜色的改变反映了本身结构和组成的变化,因此,可以判断样品的组成与结构在140~200 ℃之间发生了显著变化,在230 ℃之后达到稳定状态,该结果对应于图 1 TGA-DSC数据,即LiI·THF在170 ℃发生分解,分解产生的LiI与Li3PS4进一步反应,在230 ℃反应充分并保持稳定。

|
图 2 不同热处理温度后样品的冷压圆片实物图 Fig. 2 Cold pressed pellets of samples after different heat treatment temperatures |
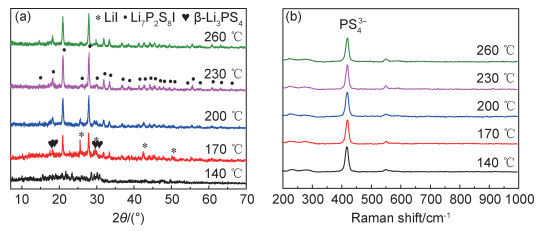
为了确定不同温度热处理后的样品物相结构,进行了XRD和Raman测试分析,结果如图 3所示。140 ℃加热后的样品衍射峰较为杂乱,强度较低,且不能与任何一种或多种已知物相的标准PDF卡片相匹配,表明混合干燥后的产物Li3PS4与LiI·THF发生了微观尺度的结合或混合,从而失去特征衍射峰。经170 ℃热处理后,在2θ=27.8°和2θ=20.93°处出现两个尖峰,对应Li7P2S8I的最强峰与次强峰[8],表明样品中主要成分为Li7P2S8I。此外,还观察到Li3PS4和LiI的衍射峰。热处理温度为200 ℃时,对应Li7P2S8I的衍射峰强度显著增强,对应Li3PS4和LiI的峰强降低。当继续升高至230 ℃时,Li7P2S8I的峰强继续增加,同时Li3PS4和LiI衍射峰消失。在260 ℃时,除了Li7P2S8I的峰强有所降低外,无其他明显变化。该测试结果与图 2中压片样品的颜色变化过程相一致。图 3(b)为不同热处理温度下所得样品的拉曼光谱,不同热处理温度样品均在418 cm-1位置有尖峰出现,对应于PS43-特征峰,且热处理温度对该特征峰的峰位和峰强无显著影响,这表明在反应前驱体和产物Li7P2S8I中都存在稳定的PS43-特征结构,与文献报道相一致[17]。
|
图 3 不同热处理温度下所得粉末样品XRD图谱(a)和Raman图谱(b) Fig. 3 XRD(a) and Raman(b) patterns of the obtained powder samples at different heat-treatment temperatures |
由以上结果可以判断,140 ℃温度较低,不能满足固态反应要求,未能生成Li7P2S8I固态电解质。当热处理温度为170 ℃时,开始发生反应生成Li7P2S8I,但反应不充分,有Li3PS4和LiI物相析出。随着热处理温度的升高,析出的Li3PS4和LiI进一步反应生成Li7P2S8I。当温度达到230 ℃时,得到较为纯净的目标产物Li7P2S8I。此外,260 ℃热处理后的样品Li7P2S8I峰强减弱,说明产物结晶度降低,经测试离子电导率为9.8×10-5 S·cm-1, 显著低于230 ℃样品。因此,可以确定Li7P2S8I固态电解质的最佳热反应温度为230 ℃。
进一步通过SEM观察了230 ℃热处理所制备的电解质粉末样品的表面形貌,结果如图 4所示。从图 4(a)中的低倍图像来看,样品颗粒呈无规则块状形态,且大多数颗粒较为碎小。图 4(b)中的高倍图像显示,该粉末样品具有纳米多孔结构,纳米晶尺寸约为100~300 nm。多孔纳米结构的形成有助于增加离子的表面传导,进而提高离子电导率[5]。通过EDS进一步观察了该样品中S,P和I元素的分布状态,结果如图 5所示。图中以上三种元素分布均匀,表明在实验第二步中LiI·THF与Li3PS4·xTHF前驱体发生了充分混合,并在后续热处理过程中反应充分。

|
图 4 230 ℃下制备的电解质粉末样品的SEM图 (a)低倍;(b)高倍 Fig. 4 SEM images of electrolyte powder sample prepared at 230 ℃ (a)low magnification; (b)high magnification |

|
图 5 230 ℃下所制备的电解质粉末样品的EDS图 Fig. 5 EDS mapping results of electrolyte powder sample prepared at 230 ℃ |
将230 ℃热处理的Li7P2S8I电解质粉末压制成圆片状,在自制绝缘树脂模具中组装成SUS/Li7P2S8I/SUS对称电池并在不同温度下进行交流阻抗测试,得到的Nyquist曲线如图 6所示。在25 ℃和35 ℃下测试的Nyquist曲线由界面转移电阻引起的高频区圆弧和电极界面处离子扩散引起的低频区瓦尔堡扩散斜线组成,具有典型离子导体的特征[22]。瓦尔堡扩散斜线与横轴的交点为所测电解质阻抗值。当测试温度超过45 ℃时,样品Nyquist曲线中只有瓦尔堡斜线,高频区阻抗弧消失,说明其界面阻抗较小。同时,电解质总阻抗也随测试温度的增加而逐渐减小。式(5)为电导率计算公式。其中,σ为电解质电导率,S·cm-1;R为总阻抗,Ω;S为压片表面积,cm2;L为压片厚度,cm。最终计算得到Li7P2S8I固态电解质在25 ℃的离子电导率为1.63×10-4 S·cm-1。图 7为Li7P2S8I固态电解质的离子电导率随测试温度的变化关系。其变化关系满足阿伦尼乌斯公式(6)。其中Ea为电解质中锂离子传导的活化能,eV;A为指前因子;k为玻尔兹曼常数,J·K-1;T为绝对温度,K。根据图 7中拟合直线的斜率可以计算其活化能为0.388 eV。

|
图 6 Li7P2S8I在不同温度下的Nyquist图 Fig. 6 Nyquist plots of Li7P2S8I at different temperatures |

|
图 7 Li7P2S8I离子电导率与温度的关系 Fig. 7 Relationship between ionic conductivity of Li7P2S8I and temperature |
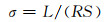
|
(5) |

|
(6) |
本工作中所制备Li7P2S8I样品的室温离子电导率低于采用乙腈[8]和丙酸乙酯[17]作为反应溶剂制备的Li7P2S8I固态电解质的室温离子电导率。可能原因如下:一方面,样品离子电导率的高低与所制备的晶体结构差异有关。本工作中样品的XRD图谱显示Li7P2S8I次强峰与最强峰的强度比为0.92,而文献中两个主峰的强度比为0.67[8]。此外,理论计算结果表明Li7P2S8I存在一些其他的结构[23],其中,阴离子混合和非混合模型表现出与上述两个峰不同的相对强度。因此,获得的较低离子电导率可能是由于样品晶体结构的差异造成的。另一方面,制备过程中使用的有机溶剂不同也可能对Li7P2S8I固态电解质的离子电导率和活化能产生强烈的影响[24]。
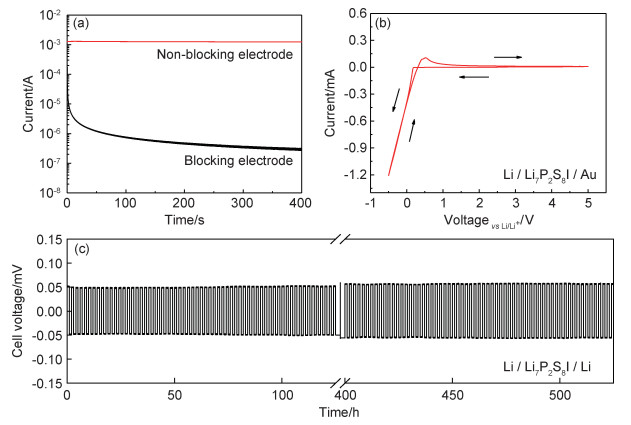
图 8(a)为Li7P2S8I固态电解质在1 V恒定电压和不同电极条件下电流随时间的变化曲线。当Li片被用作非阻塞电极(电池结构为Li/Li7P2S8I/Li)时,观察到一恒定电流。而当使用阻塞电极(电池结构为SUS/Li7P2S8I/SUS)时,电流在初始阶段由于极化过程而快速下降,然后逐渐趋于稳定,此时电流仅源自电解质中电子的贡献。从图中可明显看出,使用非阻塞电极时所观察到的恒定电流比使用阻塞电极时观察到的电流高出至少3个数量级。因此,可以认为所制备的Li7P2S8I固态电解质是纯离子导体,其锂离子迁移数大于0.999。电化学窗口是评估固态电解质电化学稳定性的一个重要指标。为此组装了Li/Li7P2S8I/Au电池进行CV测试,其中Li和Au分别作为参比/对电极和工作电极,所测得CV曲线如图 8(b)所示。除了分别对应锂沉积和锂溶解的阴极电流峰和阳极电流峰以外,在整个扫描电位范围内未观察到其他峰位,说明没有副反应发生,这表明Li7P2S8I固态电解质与金属锂电极稳定性良好,且电化学窗口达到5 V。
|
图 8 Li7P2S8I固态电解质的电化学性能 (a)恒定1 V电压,不同电极对应的电流-时间曲线;(b)Li/Li7P2S8I/Au电池在5 mV·s-1扫描速率下的CV曲线;(c)Li/Li7P2S8I/Li电池在0.1 mA·cm-2电流密度下的直流极化曲线 Fig. 8 Electrochemical properties of the Li7P2S8I solid electrolyte (a)current-time curves at a constant applied voltage of 1 V under different electrode conditions; (b)CV curves of the Li/Li7P2S8I/ Au cell at a scan rate of 5 mV·s-1; (c)DC polarization curve of the Li/Li7P2S8I/Li cell at a current density of 0.1 mA·cm-2 |
为了进一步测试Li7P2S8I固态电解质与金属锂电极的循环稳定性,组装了Li/Li7P2S8I/Li对称电池在0.1 mA·cm-2的电流密度下进行长时间充放电循环,所测得直流极化曲线如图 8(c)所示。电池稳定循环262次以上,且极化电压微弱增长,整体保持稳定,显著优于以相同方式制备β-Li3PS4的循环稳定性[14],这表明Li7P2S8I固态电解质对金属锂有着优异的化学相容性和电化学稳定性。有研究表明,Li7P2S8I本身与锂金属并不稳定,在电压为1.71 V时会发生还原[1],但Li7P2S8I与锂金属反应生成含LiI的界面层(SEI)是稳定的[17]。Li/Li7P2S8I界面上LiI的存在有利于提高SEI的离子电导率,降低其电子电导率,促进锂在界面上的均匀快速沉积,从而抑制锂枝晶的生长[13]。
3 结论(1) 以四氢呋喃为反应溶剂,通过湿化学法及后续真空热反应成功制备出具有纳米多孔结构的Li7P2S8I固态电解质。
(2) 热处理前真空干燥产物的物质组成为2Li3PS4·2.5THF+LiI·THF,随着热处理温度升高,样品颜色逐渐加深,最终转变为稳定的灰棕色Li7P2S8I,对比实验表明最佳热处理温度为230 ℃。
(3) 所制备的Li7P2S8I固态电解质室温离子电导率为1.63×10-4 S·cm-1,活化能为0.388 eV,电化学窗口达到5 V,锂离子迁移数高于0.999。
(4) 基于该电解质制备的Li/Li7P2S8I/Li对称电池充放电实现稳定循环>262次,表明该电解质与金属锂负极具有优异的电化学稳定性和化学相容性。
| [1] |
ZHU Y, HE X, MO Y. Origin of outstanding stability in the lithium solid electrolyte materials: insights from thermodynamic analyses based on first principles calculations[J]. ACS Applied Materials & Interfaces, 2015, 7(42): 23685-23693. |
| [2] |
许晓雄, 温兆银. 锂离子电池玻璃及玻璃陶瓷固体电解质材料研究[J]. 无机材料学报, 2005, 20(1): 21-26. XU X X, WEN Z Y. Glass and glass-ceramics solid electrolytes for lithium-ion battery[J]. Journal of Inorganic Materials, 2005, 20(1): 21-26. DOI:10.3321/j.issn:1000-324X.2005.01.003 |
| [3] |
McGROGAN F P, SWAMY T, BISHOP S R, et al. Compliant yet brittle mechanical behavior of Li2S-P2S5 lithium-ion-conducting solid electrolyte[J]. Advanced Energy Materials, 2017, 7(12): 1602011. DOI:10.1002/aenm.201602011 |
| [4] |
MURAMATSU H, HAYASHI A, OHTOMO T, et al. Structural change of Li2S-P2S5 sulfide solid electrolytes in the atmosphere[J]. Solid State Ionics, 2011, 182(1): 116-119. DOI:10.1016/j.ssi.2010.10.013 |
| [5] |
LIU Z, FU W, PAYZANT E A, et al. Anomalous high ionic conductivity of nanoporous β-Li3PS4[J]. Journal of the American Chemical Society, 2013, 135(3): 975-978. DOI:10.1021/ja3110895 |
| [6] |
SEINO Y, OTA T, TAKADA K, et al. A sulphide lithium super ion conductor is superior to liquid ion conductors for use in rechargeable batteries[J]. Energy & Environmental Science, 2014, 7(2): 627-631. |
| [7] |
UJⅡE S, HAYASHI A, TATSUMISAGO M. Structure, ionic conductivity and electrochemical stability of Li2S-P2S5-LiI glass and glass-ceramic electrolytes[J]. Solid State Ionics, 2012, 211: 42-45. DOI:10.1016/j.ssi.2012.01.017 |
| [8] |
RANGASAMY E, LIU Z, GOBET M, et al. An iodide-based Li7P2S8I superionic conductor[J]. Journal of the American Chemical Society, 2015, 137(4): 1384-1387. DOI:10.1021/ja508723m |
| [9] |
SEDLMAIER S J, INDRIS S, DIETRICH C, et al. Li4PS4I: a Li+ superionic conductor synthesized by a solvent-based soft chemistry approach[J]. Chemistry of Materials, 2017, 29(4): 1830-1835. DOI:10.1021/acs.chemmater.7b00013 |
| [10] |
WENZEL S, SEDLMAIER S J, DIETRICH C, et al. Interfacial reactivity and interphase growth of argyrodite solid electrolytes at lithium metal electrodes[J]. Solid State Ionics, 2018, 318: 102-112. DOI:10.1016/j.ssi.2017.07.005 |
| [11] |
LU Y, TU Z, ARCHER L A. Stable lithium electrodeposition in liquid and nanoporous solid electrolytes[J]. Nature Materials, 2014, 13(10): 961-969. DOI:10.1038/nmat4041 |
| [12] |
MA L, KIM M S, ARCHER L A. Stable artificial solid electrolyte interphases for lithium batteries[J]. Chemistry of Materials, 2017, 29(10): 4181-4189. DOI:10.1021/acs.chemmater.6b03687 |
| [13] |
HAN F, YUE J, ZHU X, et al. Suppressing Li dendrite formation in Li2S-P2S5 solid electrolyte by LiI incorporation[J]. Advanced Energy Materials, 2018, 8(18): 1703644. DOI:10.1002/aenm.201703644 |
| [14] |
李久勇, 刘伟明, 张晓锋, 等. 高离子传导纳米多孔β-Li3PS4固态电解质的湿化学法制备[J]. 材料工程, 2019, 47(9): 101-107. LI J Y, LIU W M, ZHANG X F, et al. Preparation of nanoporous β-Li3PS4 solid electrolyte with high ionic conductivity by wet chemical method[J]. Journal of Materials Engineering, 2019, 47(9): 101-107. |
| [15] |
WANG Y, LU D, BOWDEN M, et al. Mechanism of formation of Li7P3S11 solid electrolytes through liquid phase synthesis[J]. Chemistry of Materials, 2018, 30(3): 990-997. DOI:10.1021/acs.chemmater.7b04842 |
| [16] |
PHUC N H H, MORIKAWA K, MITSUHIRO T, et al. Synthesis of plate-like Li3PS4 solid electrolyte via liquid-phase shaking for all-solid-state lithium batteries[J]. Ionics, 2017, 23(8): 2061-2067. DOI:10.1007/s11581-017-2035-8 |
| [17] |
PHUC N H H, HIRAHARA E, MORIKAWA K, et al. One-pot liquid phase synthesis of (100-x)Li3PS4-xLiI solid electrolytes[J]. Journal of Power Sources, 2017, 365: 7-11. DOI:10.1016/j.jpowsour.2017.08.065 |
| [18] |
MATSUDA A, MUTO H, PHUC N H H. Preparation of Li3PS4 solid electrolyte by liquid-phase shaking using organic solvents with carbonyl group as complex forming medium[J]. Journal of the Japan Society of Powder and Powder Metallurgy, 2016, 63(11): 976-980. DOI:10.2497/jjspm.63.976 |
| [19] |
PHUC N H H, MORIKAWA K, TOTANI M, et al. Chemical synthesis of Li3PS4 precursor suspension by liquid-phase shaking[J]. Solid State Ionics, 2016, 285: 2-5. DOI:10.1016/j.ssi.2015.11.019 |
| [20] |
TERAGAWA S, ASO K, TADANAGA K, et al. Liquid-phase synthesis of a Li3PS4 solid electrolyte using N-methylformamide for all-solid-state lithium batteries[J]. Journal of Materials Chemistry A, 2014, 2(14): 5095-5099. DOI:10.1039/c3ta15090a |
| [21] |
潘亦真, 李宇杰, 陈一民, 等. 纳米多孔β-Li3PS4固体电解质的溶剂脱除法制备及性能[J]. 高等学校化学学报, 2016, 37(7): 1232-1238. PAN Y Z, LI Y J, CHEN Y M, et al. Performance of nanoporous β-Li3PS4 prepared by solvent removing method[J]. Chemical Journal of Chinese Universities, 2016, 37(7): 1232-1238. |
| [22] |
KAMAYA N, HOMMA K, YAMAKAWA Y, et al. A lithium superionic conductor[J]. Nature Materials, 2011, 10(9): 682-686. DOI:10.1038/nmat3066 |
| [23] |
KANG J, HAN B. First-principles characterization of the unknown crystal structure and ionic conductivity of Li7P2S8I as a solid electrolyte for high-voltage Li ion batteries[J]. The Journal of Physical Chemistry Letters, 2016, 7(14): 2671-2675. DOI:10.1021/acs.jpclett.6b01050 |
| [24] |
YAMAMOTO T, PHUC N H H, MUTO H, et al. Preparation of Li7P2S8I solid electrolyte and its application in all-solid-state lithium-ion batteries with graphite anode[J]. Electronic Materials Letters, 2019, 15(4): 409-414. DOI:10.1007/s13391-019-00133-y |
 2021, Vol. 49
2021, Vol. 49


