文章信息
- 范泽文, 赵新宇, 邱帅, 王艳, 郭静, 权慧欣, 徐兰娟
- FAN Ze-wen, ZHAO Xin-yu, QIU Shuai, WANG Yan, GUO Jing, QUAN Hui-xin, XU Lan-juan
- 聚乳酸/聚乙二醇/羟基磷灰石多孔骨支架的3D打印制备及其生物相容性
- 3D printing of polylactic acid/poly ethylene glycol/hydroxyapatite porous bone scaffolds and their biocompatibility
- 材料工程, 2021, 49(4): 135-141
- Journal of Materials Engineering, 2021, 49(4): 135-141.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2020.000390
-
文章历史
- 收稿日期: 2020-04-30
- 修订日期: 2020-07-06
2. 大连医科大学附属第一医院, 辽宁 大连 116011;
3. 郑州大学附属郑州中心医院, 郑州 450007
2. First Affiliated Hospital of Dalian Medical University, Dalian 116011, Liaoning, China;
3. Zhengzhou Central Hospital Affiliated to Zhengzhou University, Zhengzhou 450007, China
骨组织生物工程支架材料可用于骨的修复和替代,能够为特定的细胞提供结构支撑,还可以作为模板引导组织再生和控制组织结构。骨组织支架材料的选择、改性和结构设计已经成为骨组织生物工程材料领域中重要的研究方向[1-3]。3D打印技术近来已被广泛用于生物医学领域[4],其最大的优势是可利用数字化模型快速成型精准复杂的制品。多孔支架的成型可以借助3D打印技术获取适合的孔径,调控细胞在支架表面和内部的生长、增殖和分化。
聚乳酸(PLA)因其具有良好的物理、化学和生物性能,被广泛应用于组织工程支架领域,但同时存在生物活性低和韧性差等缺点,这极大限制了PLA在骨组织生物工程材料领域的应用[5-6]。Rosenzewig等[7]采用3D打印技术成功制备ABS和PLA两种生物支架,并对原代关节软骨细胞和髓核细胞在支架上的生长、生存能力和组织代谢等进行研究。除了直接对PLA进行打印外,对其改性也是研究的重点。Tiziano等[8]采用3D打印成型方法,用聚乙二醇(PEG)和具有生物活性的磷酸钙(CaP)玻璃对PLA进行改性并成功制备生物支架。结果表明,随着PEG的加入,PLA/PEG/CaP玻璃复合材料的亲水性和弹性模量会增加,而PEG含量过高会导致复合材料三维结构不均匀及力学性能的下降;体外降解研究表明,PEG的加入显著加速复合材料的降解速度,同时也改善了PLA的加工性能。
本工作通过利用PEG的两亲性、生物相容性[9]以及HA的生物活性和对PLA的增强效果[10],通过共混改性获取力学性能改善和生物相容性好的PLA/PEG/HA复合线材,并利用熔融沉积(FDM)3D打印技术获取多孔支架。并证明了复合材料具有良好的生物相容性,为PLA复合材料在生物工程支架领域的应用提供基础数据和理论指导。
1 实验材料与方法 1.1 实验原料聚乳酸:4032D,美国NatureWorks公司;聚乙二醇:相对分子量2000,日本青木株式会社;羟基磷灰石:5~20 μm,上海圻明生物科技有限公司。
1.2 样品制备将PLA在80 ℃烘箱中干燥12 h后与PEG/HA(按不同比例)熔融混合挤出(转矩流变仪,Polylab QB),包括纯PLA共6组,并牵引获得直径约为1.75 mm的线材。质量组成分别为(1)PLA:质量为200 g;(2)~(6):PLA与PEG的质量比均为9∶1,且总质量为200 g,HA的添加量分别为0%(质量分数,下同), 2%(4 g), 4%(8 g), 6%(12 g), 8%(16 g)。试样(1)~(6)依次简称为PLA, HA0, HA2, HA4, HA6, HA8。
1.3 结构表征与性能测试 1.3.1 3D打印力学试样及多孔支架表征根据GB/T 1040标准,利用CAD设计拉伸、冲击试样的3D打印模型和多孔支架模型,如图 1(a),(b) 所示(d=14 mm,h=2 mm)。按1.2节的方法制备线材并3D打印试样。CR-10(400)型3D打印机参数及设置:喷头内径0.4 mm,温度200 ℃,底板温度40 ℃,打印层厚0.1 mm,打印速率50 mm/s,填充率100%(线性填充);打印方向如图 1(a)所示(拉伸试样平行于拉伸方向,冲击试样垂直于冲击方向)。多孔支架的打印条件不变,填充率为0。

|
图 1 3D打印拉伸、冲击试样模型(a)和多孔支架模型(b) Fig. 1 Models of tensile, impact samples(a) and porous scaffold(b) for 3D printing |
分别称取一定量的PLA, HA0, HA2, HA4, HA6, HA8用作DSC(QAT-2000)测试,起始温度40 ℃,以10 ℃/min升温到200 ℃,保持3 min再以10 ℃/min降温到40 ℃,消除热历史后以10 ℃/min升到200 ℃,记录第二次升温曲线。
1.3.3 流动性分析把挤出线材于190 ℃,10 MPa模压成直径25 mm,厚度1 mm的圆片。依靠DHR-2型旋转流变仪运动产生剪切流动来确定材料的黏性。测试条件:剪切扫描模式,温度190 ℃,剪切速率1~3500 rad·s-1。
1.3.4 支架形态及细胞黏附SEM观察HA2复合材料线材做原料,将图 1(b)的多孔支架模型实体打印出来。在JSM6460LV型扫描电子显微镜下进行形态观察。
将大鼠骨髓间充质干细胞消化后离心,重悬制备成细胞悬液后以1×105个/孔的浓度接种到支架材料表面培养24 h,室温下4%多聚甲醛固定6 h,经30%, 40%, 50%, 70%, 80%, 90%, 95%, 100%浓度无水乙醇脱水,每一浓度脱水15 min,100%浓度脱水两次,充分干燥后于扫描电镜下观察细胞生长情况。
1.3.5 细胞骨架及细胞核的激光扫描共聚焦(LSCM)观察将大鼠骨髓间充质干细胞消化后离心,重悬制备成细胞悬液后以1×105个/孔的浓度接种到支架材料表面培养24 h,室温下4%多聚甲醛固定30 min后分别进行鬼笔环肽和DAPI染色,清洗后于FV1000型激光共聚焦显微镜下观察。
1.3.6 力学性能测试拉伸性能测试(Instron5900电子万能材料试验机):将复合材料线材及3D打印(哑铃形)样条在室温下以20 mm/min的拉伸速率进行静态拉伸测试,记录材料的拉伸强度、断裂伸长率和弹性模量。
冲击性能测试(XJUY-22Z悬臂梁冲击试验机):缺口深度2 mm,记录冲击强度。
2 结果与分析 2.1 3D打印线材的力学性能分析3D打印线材力学性能的好坏直接影响着打印制品的质量。图 2为PLA/PEG/HA复合线材的力学性能测试曲线。添加PEG后PLA的断裂伸长率由约10%提高到约18%,因为PEG可以充当PLA的增塑剂,有助于PLA分子链的伸展,并且PEG分子能进入到PLA大分子中增加PLA分子的空间体积,削弱PLA分子的相互作用力从而增加PLA韧性[11]。添加HA后断裂伸长率迅速下降,HA属无机粒子,具有小尺寸效应,它的添加会阻碍HA0分子链构象的转变,降低HA0的韧性,但有增强PLA的作用;所以复合材料在屈服之前,HA2的弹性模量要比PLA高,HA4, HA6也依然如此,HA6的弹性模量最高,比PLA高出约1 GPa。但HA8无论是拉伸强度还是弹性模量表现均较差,这可能是由于HA含量过高产生了团聚,另一个原因可能是HA可以充当PLA异相成核剂诱导其结晶[12],并因HA含量过高可能使晶粒结晶不完善产生缺陷导致力学性能下降[13]。这与后边DSC的分析结果一致。PLA/PEG/HA线材的具体拉伸性能参数如表 1所示。
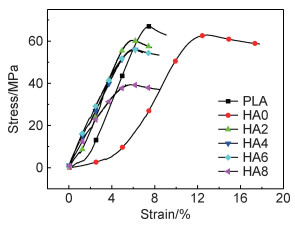
|
图 2 PLA/PEG/HA线材的拉伸性能曲线 Fig. 2 Tensile properties of PLA/PEG/HA filaments |
| Sample | Tensile strength/MPa | Elongation at break/% |
Elastic modulus/ GPa |
| PLA | 67.10 | 9.56 | 5.44 |
| HA0 | 63.16 | 17.75 | 3.11 |
| HA2 | 60.25 | 7.65 | 5.81 |
| HA4 | 56.07 | 6.89 | 6.23 |
| HA6 | 55.67 | 8.33 | 6.51 |
| HA8 | 39.22 | 8.37 | 5.94 |
打印温度和底板温度的设定是一个非常重要的参数,对打印质量有决定性影响,所以需要知道各组分的熔点和玻璃化转变温度,从而设置合适的打印温度。图 3为PLA/PEG/HA复合材料的第二次升温DSC曲线。纯PLA的熔点(Tm)为167.72 ℃,冷结晶温度(Tcc)为106.64 ℃,玻璃化转变温度(Tg)为61.39 ℃。添加PEG后,HA0只有一个略低于纯PLA的Tm,为167.39 ℃,说明PLA与PEG相容性较好;HA0的Tcc为85.58 ℃,与纯PLA相比,降低约18 ℃,这可能是因为PEG分子会进入到PLA大分子中,增加PLA分子的空间体积,削弱PLA分子之间的作用力,有助于PLA分子链运动,增加链的柔顺性降低Tg和Tm[14]。也由于PEG增加了PLA分子的运动能力,有利于它的相互排列,从而降低了PLA的Tcc[15-16]。而HA可以充当PLA异相成核剂诱导其结晶[12],并且会阻碍PLA分子链运动,从而提高PLA的Tcc,而且随着HA含量增加Tcc一直增加,无论是HA2, HA4, HA6, 还是HA8,都要比HA0的Tcc要高。而HA的添加虽然可以提高Tcc,但可能因其成核并不完善不能提高PLA的Tm,反而随着HA含量增加Tm一直降低[13]。HA8的Tm为161.02 ℃,与PLA的Tm相比降低了约7 ℃,这对加工温度影响较大。Tm的降低也将有助于PLA/PEG/HA线材制备和打印成型。PLA/PEG/HA复合材料的具体结晶参数如表 2所示, 其中ΔHcc为冷结晶焓,ΔHm为熔融焓。
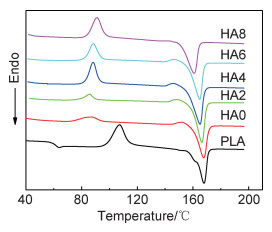
|
图 3 PLA/PEG/HA复合材料的DCS曲线 Fig. 3 DSC curves of PLA/PEG/HA composites |
| Sample | Tg/℃ | Tcc/℃ | ΔHcc/ (J·g -1) |
Tm/℃ | ΔHm/ (J·g -1) |
| PLA | 61.39 | 106.64 | 28.42 | 167.72 | 38.63 |
| HA0 | 88.89 | 7.22 | 167.39 | 40.93 | |
| HA2 | 85.96 | 5.07 | 166.30 | 32.37 | |
| HA4 | 87.42 | 16.40 | 164.99 | 38.21 | |
| HA6 | 88.67 | 14.91 | 164.32 | 37.65 | |
| HA8 | 91.32 | 18.96 | 160.46 | 36.18 |
线材的流动性和黏度对成型制品的好坏有直接的影响,图 4为PLA/PEG/HA复合材料的流动性曲线。在低剪切频率下表观黏度(η*)基本保持不变,表现为牛顿流体特性,在高剪切频率下熔体表现为剪切变稀,为典型的假塑性非牛顿流体行为。在剪切速率较小时,PLA和HA0的η*较大,这可能是因为PLA的分子链和PEG的分子链可以形成一种拟网状的缠结结构使阻力增加导致的[17]。同时发现HA0的η*比PLA大,这可能是因为PEG分子进入到PLA大分子中增加了整个链的缠结使阻力增加所导致的。掺入HA后HA2的η*下降很多,这可能是因为在剪切过程中HA粒子可以充当润滑剂,使运动单元跃迁较为容易。对于HA4和HA6组分来说,初始η*降到最低,在410 rad/s下HA6的η*只有7.2×10-4 Pa·s,而在适当的剪切速率下(8~20 rad·s-1),HA4, HA6的熔体黏度要比PLA降低4个数量级。这除了在高剪切的作用下,HA充当润滑剂的作用也尤为明显。HA8因为HA粒子间也存在一定的摩擦力,润滑剂的作用明显下降。从而阻碍了运动单元的跃迁,所以HA8的η*不降反升。而降低PLA的η*也有助于其加工成型和3D打印成型。
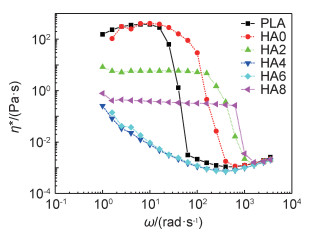
|
图 4 PLA/PEG/HA复合材料的表观黏度(η*)与剪切速率(ω)曲线 Fig. 4 Relationship between apparent viscosity(η*) and shear rate(ω) of PLA/PEG/HA composites |
选取4组力学性能较好的线材来做3D打印的原料,4组打印线材分别是PLA, HA0, HA4和HA6。挤出过程中发现HA8线材的流动性不好,不适合做打印线材。图 5为力学试样的打印实体,观察发现其打印质量与成型精度都很高。说明挑选的线材完全可以3D打印,这为后期打印多孔支架提供了可行性保障。

|
图 5 3D打印拉伸和冲击试样的光学图片 Fig. 5 Optical pictures of 3D printed tensile specimens and impact specimens |
图 6为3D打印样条拉伸测试曲线。与线材结果类似,PEG的添加增加PLA分子的空间体积,有助于PLA分子链运动,从而提高其韧性。HA虽有增强高分子材料的作用,但3D打印成型由于其增材的特性,会削弱试样的整体性,导致HA增强效果下降,不过依然保留了一定的力学性能可以满足多孔支架的基本要求。
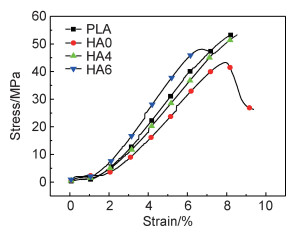
|
图 6 3D打印试样的拉伸性能曲线 Fig. 6 Tensile properties of 3D printed specimens |
表 3为3D打印成型冲击试样的测试结果。如表所示PLA的冲击强度为1.744 kJ/m2,而PEG的添加增加了PLA分子的空间体积,有助于PLA分子链的运动从而提高其韧性,使HA0冲击强度提高。然而,HA虽有增强PLA的作用,但它的添加使材料刚性增加,降低冲击强度。而且3D打印成型会使制品中存在打印结点,削弱材料的整体性;并且打印方向与冲击方向垂直,这些可能都会在一定程度上削弱PEG的增韧效果,降低HA0冲击强度。DSC和线材拉伸结果表明,PEG增韧明显,而且与PLA相容性较好,这使得即使添加HA后,冲击强度还是会得到较大的保留,依然高于纯PLA。
| Sample | Impact strength/(kJ·m-2) |
| PLA | 1.744 |
| HA0 | 2.495 |
| HA4 | 2.225 |
| HA6 | 2.131 |
组织工程支架的孔结构对细胞的黏附、迁移和增殖有重要的影响,其中孔径的尺寸在很大程度上决定着细胞能不能在支架材料中迁移和生长[18]。图 7为3D打印PLA/PEG/HA复合材料多孔支架的SEM照片。图 7(a)为多孔支架的表面,其孔径约为800 μm;图 7(b)为它的局部表面放大图。图 7(c)为多孔支架断面,其孔径约为400 μm;图 7(d)为其局部断面放大图。从图 7(a)~(d)可以看出3D打印多孔支架实体的孔径十分规整,打印效果好且打印精度高,这为细胞在支架材料中迁移、生长以及动物体内和体外实验的可行性提供基础保证。此外,从图 7(e)~(f)能看出,支架表面存在一定的粗糙度。这对细胞的黏附、增殖、迁移和分化等也起到促进作用。

|
图 7 PLA/PEG/HA复合材料多孔支架的SEM照片 (a),(b)表面;(c),(d)截面;(e),(f)表面放大图像 Fig. 7 SEM images of porous scaffold of PLA/PEG/HA composites (a), (b)surface; (c), (d)section; (e), (f)surface enlarged image |
细胞在材料表面的黏附、铺展对评价组织工程材料的性能具有相当重要的意义。图 8为大鼠骨髓间充质干细胞(bone marrow mesenchymal stem cells, BMSC)在多孔支架上的黏附和标记的结果。图 8(a)为大鼠BMSC在多孔支架上的黏附状况,细胞在材料表面12 h即形成了稳定的黏附,并从图 8(b)可看出部分细胞开始在材料表面铺展,表明支架具有良好的生物相容性。并且通过激光扫描共聚焦显微镜(laser scanning confocal microscope, LSCM)对大鼠BMSC在支架表面上的黏附进行观察。图 8(c)为大鼠BMSC的24 h细胞骨架的荧光标记结果,图 8(d)为大鼠BMSC的24 h细胞核荧光标记结果,结果显示大鼠BMSC的细胞核和细胞骨架形态良好,表明多孔支架具有良好的生物相容性且无毒性。这为PLA/PEG/HA复合材料成为骨组织工程材料提供了重要的保障,也拓宽了3D技术在定制生物支架上的应用。
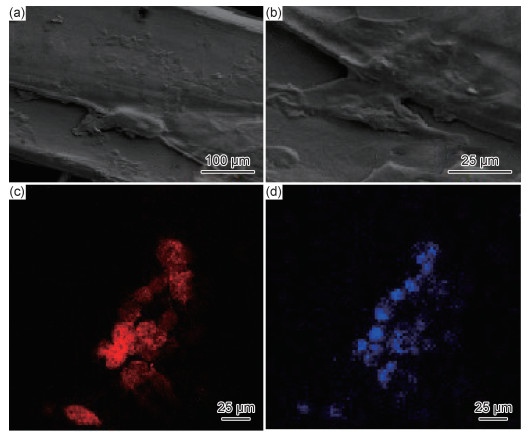
|
图 8 大鼠间充质干细胞在多孔支架上的生物相容性测试 (a),(b)细胞在生物支架表面的黏附;(c)荧光标记的细胞骨架;(d)荧光标记的细胞核 Fig. 8 Biocompatibility test of rat mesenchymal stem cells on porous scaffolds (a), (b)cell adhesion on biological scaffold surface; (c)cytoskeleton of the fluorescent label; (d)nucleus of the fluorescent label |
(1) 利用熔融共混技术制备不同组分的PLA/PEG/HA复合线材,并通过分析复合材料的各种性能,筛选出适合3D打印成型的线材,并成功制备出力学性能优异的试样及生物相容性好、孔径规整的多孔支架。
(2) PEG的添加把PLA线材断裂伸长率由约10%提高到约18%,Tcc降低约18 ℃;加入HA后,PLA的弹性模量最多提高约1 GPa,Tm最多降低约7 ℃;而在适当的剪切速率下(8~20 rad·s-1),HA4, HA6的熔体黏度要比PLA降低4个数量级。
(3) 多孔支架的表面孔尺寸约为800 μm,断面孔尺寸约为400 μm;这个孔径的支架表面适合细胞的黏附、增长与分化;多孔支架与细胞12 h即形成了稳定的黏附与铺展;24 h后,细胞骨架与细胞核的形态良好,细胞生长、生存状况极佳。多孔支架的成功制备,为其在生物医学方面的应用提供了一些数据支持,为进一步发掘改性3D打印线材在生物医学方面的应用提供了可能。
| [1] |
张平生, 辛勇, 曹传亮, 等. 壳聚糖/羟基磷灰石表面修饰聚己内酯多孔骨支架的制备及性能[J]. 材料工程, 2019, 47(7): 64-70. ZHANG P S, XIN Y, CAO C L, et al. Preparation and properties of polycaprolactone porous bone scaffold modified with chitosan/hydroxyapatite on the surface[J]. Journal of Materials Engineering, 2019, 47(7): 64-70. |
| [2] |
谌斯. 聚乳酸基纳米纤维仿生骨组织工程支架的构建与成骨性能研究[D]. 广州: 华南理工大学, 2018. SHEN S. Construction and osteogenesis capacity study of biomimetic poly(L-lactic acid) nanofiber bone tissue engineering scaffolds[D]. Guangzhou: South China University of Technology, 2018. |
| [3] |
舒华金, 吴春萱, 杨康, 等. 快速膨胀海藻酸钠/二氧化硅纤维复合支架的制备及其快速止血功能的应用[J]. 材料工程, 2019, 47(12): 124-129. SHU H J, WU C X, YANG K, et al. Preparation of rapid expansion alginate/silica fiber composite scaffold and application of rapid hemostatic function[J]. Journal of Materials Engineering, 2019, 47(12): 124-129. |
| [4] |
SINGH O P, AHMED S M, ABHILASH M. Modern 3D printing technologies: future trends and developments[J]. Recent Patents on Engineering, 2015, 9(2): 91-103. DOI:10.2174/1872212109666150213000747 |
| [5] |
魏泽昌, 蔡晨阳, 王兴, 等. 生物可降解高分子增韧聚乳酸的研究进展[J]. 材料工程, 2019, 47(5): 34-42. WEI Z C, CAI C Y, WANG X, et al. Research progress on toughening polylactic acid by renewable and biodegradable polymers[J]. Journal of Materials Engineering, 2019, 47(5): 34-42. |
| [6] |
BHASKAR B, OWEN R, BAHMAEE H, et al. Composite porous scaffold of polyethylene glycol (PEG)/polylactic acid (PLA) support improved bone matrix deposition in vitro compared to PLA -only scaffolds[J]. Journal of Biomedical Materials Research: Part A, 2018, 106(5): 1-23. |
| [7] |
ROSENZEWIG H R, CARELLI E, STEFFEN T, et al. 3D-printed ABS and PLA scaffolds for cartilage and nucleus pulposus tissue regeneration[J]. International Journal of Molecular Sciences, 2015, 16(7): 15119-15135. |
| [8] |
TIZIANO S, MONICA O H, ELISABETH E, et al. Relevance of PEG in PLA-based blends for tissue engineering 3D-printed scaffolds[J]. Materials Science Engineering C, 2014, 38(1): 55-62. |
| [9] |
MEUNIER M, GOUPIL A, LIENARD P. Predicting drug loading in PLA-PEG nanoparticles[J]. International Journal of Pharmaceutics, 2017, 526(1): 157-166. |
| [10] |
WANG F, HU Y, HE D, et al. Scaffold-free cartilage cell sheet combined with bone-phase BMSCs-scaffold regenerate osteochondral construct in mini-pig model[J]. American Journal of Translational Research, 2018, 10(10): 2997-3010. |
| [11] |
吴景梅, 丁厚远. 聚乙二醇改性聚乳酸的合成与表征[J]. 塑料工业, 2016, 44(11): 34-36. WU J M, DING H Y. Characterization and synthesis of polyethylene glycol modified PLA[J]. Plastics Industry, 2016, 44(11): 34-36. |
| [12] |
YAO Q, SONG Z, LI J, et al. Micromorphology, mechanical, crystallization and permeability properties analysis of HA/PBAT/PLA degradability packaging films[J]. Polymer International, 2019, 69(3): 5953-5959. |
| [13] |
梁多平, 智慧, 孙智慧, 等. 改性纳米HA对PLA-PBAT共混体系结晶与流变性能的影响[J]. 复合材料学报, 2014, 31(3): 569-577. LIANG D P, ZHI H, SUN Z H, et al. Effects of modified nano HA on crystallization and rheological properties of PLA-PBAT blends[J]. Acta Materiae Compositae Sinica, 2014, 31(3): 569-577. |
| [14] |
WANG N, ZANG Y J, REN G Z, et al. Fabrication and properties of porous scaffolds of PLA-PEG biocomposite for bone tissue engineering[J]. Materials Science Forum, 2014, 789(1): 130-135. |
| [15] |
JIA S, YU D, WANG Z, et al. Morphologies, crystallization, and mechanical properties of PLA-based nanocomposites: synergistic effects of PEG/HNTs[J]. Journal of Applied Polymer Science, 2019, 1(1): 47385-47395. |
| [16] |
郭姝, 邹涛, 赵瑾, 等. PEG、PPG改性PLA材料的性能研究[J]. 中国塑料, 2018, 32(3): 44-50. GUO S, ZOU T, ZHAO J, et al. Study on properties of poly (lactic acid)/polyethylene glycolor polypropylene glycol blends[J]. China Plastics, 2018, 32(3): 44-50. |
| [17] |
金日光, 华幼卿. 高分子物理[M]. 4版. 北京: 北京工业出版社, 2013: 263-267. JIN R G, HUA Y Q. Polymer physics[M]. 4th ed. Beijing: Beijing Industry Press, 2013: 263-267. |
| [18] |
谢燕, 包睿莹, 杨鸣波, 等. 聚多巴胺包覆对立构复合聚乳酸支架性能的影响[J]. 高分子材料科学与工程, 2018, 34(8): 43-47. XIE Y, BAO R Y, YANG M B, et al. Effect of poly(dopamine) coating on the performance of stereocomplex polylactide scaffolds[J]. Polymer Materials Science and Engineering, 2018, 34(8): 43-47. |
 2021, Vol. 49
2021, Vol. 49


