文章信息
- 陶承东, 刘传宝, 李扬, 乔利杰, 周济, 白洋
- TAO Cheng-dong, LIU Chuan-bao, LI Yang, QIAO Li-jie, ZHOU Ji, BAI Yang
- 基于超材料的无标记光学生物传感
- Metamaterial-based label-free optical biosensing
- 材料工程, 2021, 49(4): 1-12
- Journal of Materials Engineering, 2021, 49(4): 1-12.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2020.000990
-
文章历史
- 收稿日期: 2020-10-26
- 修订日期: 2021-01-07
2. 清华大学 材料学院, 北京 100084
2. School of Materials Science and Engineering, Tsinghua University, Beijing 100084, China
超材料(metamaterials)是由大量周期性排列的亚波长结构单元组成的人工电磁材料,通过精心设计单元的几何结构和排布方式,超材料对于电磁波的调控展示出前所未有的灵活性,实现了负折射[1]、完美透镜[2]、电磁隐身[3]等一系列超常物理特性,在材料学、电磁学等不同领域中都引起了人们的广泛关注。此外,超材料在其表面支持高度局域场增强,对周围介电环境的变化极其敏感,在无标记光学生物传感领域具有重要应用前景。光学生物传感器可实现生物分子及其相互作用的快速无损检测,对于疾病的早期诊断、生物医药研究以及环境监测等方面[4-6]都具有重要意义。传统的光学生物传感器主要基于表面等离子体共振(surface plasmon resonance, SPR)和局域表面等离子体共振(localized surface plasmon resonance, LSPR)两种机理,往往面临着体积庞大、灵敏度不足、功能单一等缺点,难以满足日益复杂的实际应用需求。而超材料生物传感器能够支持更加丰富的电磁模态,具有更加优异的灵敏度,易于小型化和集成化,而且在功能设计上更具灵活性,是发展下一代高性能生物传感芯片的重要方案之一。本文将按照工作频率分类,分别总结可见光与近红外、中红外以及太赫兹波段超材料生物传感器的研究进展,包括折射率生物传感、表面增强拉曼散射、表面增强红外吸收和太赫兹生物传感等(图 1)[7-9]。
1 可见光与近红外波段超材料生物传感器可见光与近红外波段超材料生物传感器主要用于折射率生物传感,能够对生物分子及其相互作用进行高灵敏检测。在过去的十几年内,研究者们提出了一系列基于法诺共振超材料、双曲超材料、拓扑暗点等离子体超材料以及表面增强拉曼散射超材料等来实现新型无标记光学生物传感器,有效提高了光学生物传感器的灵敏度和品质因数,实现了较低的浓度检测极限;并且,这些新型生物传感器能够与先进微纳加工技术相结合,可获得小型化和集成化的功能器件。
1.1 法诺共振超材料法诺共振被定义为一种引起非对称线形的共振散射现象,通常由连续态和离散态相互干涉形成[10-11]。法诺共振最初在原子物理和量子力学领域被广泛研究,近年来研究者在等离子体超材料和超表面中都实现了这一现象。法诺共振具有极其尖锐的共振峰以及高度增强的电场,非常适用于化学检测和生物传感。
在等离子体超材料中,一般是通过打破纳米结构的对称性来获得法诺共振。例如,2009年Liu等[12]通过实验证明了可见光波段平面超材料的类电磁诱导透明现象,得到了较为尖锐的反射峰。该结构由光学“亮模”偶极天线和光学“暗模”四极天线组成(图 2(a)),最终实现了588 nm/RIU的折射率灵敏度,品质因数为3.8。2014年,Moritake等[13]利用非对称双棒结构实现了尖锐的法诺共振,其品质因数最高为7.34。另一种实现法诺共振的方法是设计复合结构实现“亮”/“暗”模态的杂化,其基本原理是利用“亮”/“暗”模态之间的弱耦合和干涉效应。2011年,Zhang等[14]对玻璃基板上银纳米块的等离子体模相互作用进行了理论分析,发现当金属纳米块靠近介质基板时,会产生新的等离子体模,并且“亮”模态和“暗”模态以近似简并态耦合。该结构具有约954 nm/RIU的折射率灵敏度和12~20的高品质因数。2013年,Shen等[15]设计了一种亚微米金“蘑菇”阵列用于折射率生物传感,品质因数高达108,克服了局域型表面等离子体共振生物传感器品质因数较低的缺点,接近传播型表面等离子体共振生物传感器的理论极限,折射率灵敏度达到1010 nm/RIU。此外,波导耦合光栅结构也有助于在超材料中产生法诺共振。由于光栅结构不仅表现为导模共振,而且还具有法布里-珀罗腔谐振,因此许多研究者据此设计谐振峰来制作高性能的传感器。2011年,Lee等[16]报道了由周期性纳米凹槽与单纳米狭缝组成的法诺共振传感器,其品质因数为48,灵敏度为615 nm/RIU。此后,他们又通过实验展示了一种由镀金纳米狭缝阵列组成的新结构(图 2(b))[17],进一步改善器件性能,波长灵敏度提升至926 nm/RIU,品质因数也达到252。
|
图 2 用于光学生物传感的法诺共振超材料 (a)由光学“亮”偶极天线和光学“暗”四极天线组成的法诺共振超材料[12];(b)金纳米狭缝阵列法诺共振超材料[17] Fig. 2 Fano resonant metamaterials for optical biosensing (a)Fano resonant metamaterials consisting of an optical 'bright' dipole antenna and an optical 'dark' quadrupole antenna[12]; (b)capped gold nanoslits array Fano resonant metamaterial[17] |
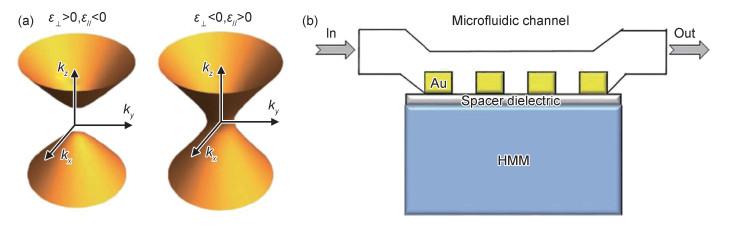
双曲超材料是一类具有双曲型色散曲线的高度各向异性超材料[18]。其相对介电常数张量的一个主分量与其他两个主分量具有相反的符号。这里仅考虑等效介电常数为各向异性的双曲超材料:
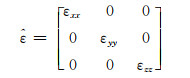
|
(1) |
假设光轴沿z方向,εxx=εyy=ε⊥表示垂直于光轴的相对介电常数,εzz=ε// 表示平行于光轴的相对介电常数,双曲超材料的相对介电常数张量满足ε⊥·ε// < 0。此时,横磁波入射双曲超材料的等频率色散曲线可表示为
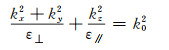
|
(2) |
式中:k0=ω/c为真空中波矢大小;c为真空中光速;kx,ky,kz分别为x,y,z方向波矢。由于ε⊥·ε// < 0,双曲超材料的等频率色散曲线为双曲面(图 3(a))。根据ε⊥和ε// 的符号方向,双曲超材料可分为ε⊥>0, ε// < 0和ε⊥ < 0, ε//>0两种类型。
由于独特的双曲型色散曲线,双曲超材料能够实现高灵敏生物传感。2009年,Kabashin等[19]采用直立式自组装金纳米棒结构作为一种双曲超材料生物传感器,将折射率灵敏度提高至3×104 nm/RIU以上,品质因数达到330。该装置采用衰减全反射的方式,在棱镜上附着金纳米棒双曲超材料并覆盖微流体通道,宽带光源从棱镜一侧斜入射,在对应的另一侧接收器件反射信号。由于待检测生物分子与局域增强电场的充分接触,实现了折射率灵敏度的极大提高。2016年,Sreekanth等[20]利用金膜(16 nm)和氧化铝膜(20 nm)交替堆叠的方式,实现了光栅耦合双曲超材料生物传感器。在折射率生物传感实验中,波长灵敏度达到3×104 nm/RIU,同时品质因数达到590,性能优于以往基于表面等离子体共振的光学生物传感器;且该器件在可见光到近红外的宽波长范围内支持高度局域的体等离激元模式,能够在皮摩尔浓度下检测小生物分子(244 g/mol)。同年,该作者基于相同的结构(图 3(b)),使用角度扫描测量技术,生物传感器的角度灵敏度高达7000(°)/RIU[21]。基于双曲超材料的生物传感器具有极高的灵敏度,且易于小型化和集成化,为下一代高性能片上集成检测系统提供了思路。
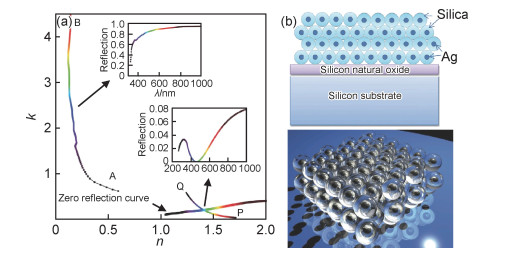
1.3 能够实现拓扑暗点的等离子体超材料为了进一步提高超材料生物传感器的灵敏度,研究者将电磁波相位作为检测手段,其灵敏度比采用波长或强度作为检测手段的传感器高1~2个数量级。2012年,Kravets等[22]提出了拓扑暗点的概念,利用光强急剧下降时产生的奇异相位来进行生物传感,达到了单分子检测的灵敏度。在二维光学常数(n, k)平面内,若器件的有效色散曲线(neff(λ), keff(λ))在由零反射曲线分开的两个不同区域开始和结束,满足约当曲线定理,则该器件可以在一定的入射角度和频率下精确地完全抑制反射,从而实现拓扑暗点。该作者通过电子束曝光的方法制备出等离子体金纳米复合光栅超材料结构,在实验上首次实现拓扑暗点和奇异相位,并通过使用石墨烯的可逆加氢和链霉亲和素-生物素结合等实验,分别证明了10-15 g/mm2级的区域质量敏感性和单个生物分子检测的灵敏度。随后,Malassis等[23]在2014年提出了一种自组装核壳等离子体超材料结构(图 4),以一种更为经济的方式实现了光学拓扑暗点,大大扩展了奇异相位生物传感器的应用范围。
拉曼散射指的是入射光子与物质分子发生非弹性碰撞而引起频率变化的一种散射现象。通过分析与入射光频率不同的拉曼散射光,能够得到待检测物质的分子结构指纹,从而实现物质分子组成和结构形态的无损定性检测。拉曼散射用途广泛,但由于其固有的小散射截面,将拉曼散射直接应用于生物传感还比较困难。直到1974年,Fleischmann等[24]观察到吡啶在电化学粗化银上的拉曼信号增强。1977年,Albrecht等[25]指出这是一种与粗糙表面相关的表面增强效应,称为表面增强拉曼散射(surface-enhanced Raman scattering, SERS)。尽管通过各种粗糙的金属表面或纳米结构提高了SERS信号增强因子,但其应用仍受到增强信号重现性差等问题的限制。大多数SERS基底只能在单个激发波长下工作,因此需要不同类型的基底进行不同激发波长的分析。在设计光学谐振特性方面,超材料可以作为SERS基底实现多种功能。2013年,Cao等[26]展示了一种可以进行SERS单分子检测的高度可调谐可见光-近红外超材料传感器,由具有电、磁谐振峰的开口谐振环(图 5(a))组成,通过SERS光谱采集,信号增强因子约为6.5×107,足以达到单分子检测的灵敏度。此外,在各种超材料中,纳米圆盘结构因具有容易制造、极化不敏感、参数控制简单等优点,被广泛用作SERS基底[27-28]。其表面等离激元和局域表面等离激元的共振波长可以通过改变超材料的单元直径和阵列周期进行调控。2010年,Chu等[29]提出了由金圆盘阵列-绝缘层-金膜等构成的三明治型双共振等离子体超材料结构,信号增强因子达到7.2×107,比玻璃衬底上的金纳米颗粒阵列的信号增强因子大两个数量级。此外,纳米孔等离子体超材料结构也因易于制备、性能优异引起了人们的广泛关注。2013年,Jiao等[30]利用二维纳米孔金膜获得了5.0×107的信号增强因子。2015年,Zhang等[31]设计了一种分层多孔等离子体超材料作为三维SERS基底(图 5(b)),提供了大量的拉曼活性结合位点,表现出了良好的重现性以及对芳香族分子的超灵敏检测,检测极限达到10-13 mol/L。
中红外光谱对应着多种生物分子的特征振动指纹[32]。通过获取这种振动指纹,中红外光谱能够以非破坏、无标签方式提供生物分子精细的生化信息,适合于检测、识别多种不同种类的生物分子。然而,由于中红外波长(2~6 μm)与生物分子尺寸(< 10 nm)之间的巨大尺度失配,振动吸收信号非常微弱,在检测纳米样品、生物膜或表面结合分子数量较少时,中红外光谱的灵敏度较低[33-34]。而采用表面增强红外吸收(surface-enhanced infrared absorption, SEIRA)可有效克服这一局限。当亚波长谐振器的谐振峰与分子振动指纹重叠时,局域增强的电场可以增强分子与谐振器之间的耦合,导致谐振频率和强度的变化,从而提取分子指纹。这一方法已在多种金属基超材料中实现并用于生物信息检测[35-36]。
2.1 金属基超材料金属基超材料具有亚波长结构单元,支持局域表面等离子体共振等丰富的电磁模态,能够将光聚焦到亚波长尺度范围内,是优良的SEIRA基底材料。近年内,已经提出了多种基于金属基超材料的SEIRA纳米光子生物传感方案。其中,棒型纳米天线超材料结构[37]由于具有较大的偶极矩、简单的谐振模式和天线尖端较强的近场局域性,是一种理想的生物传感平台。在早期关于共振纳米天线耦合生物分子的实验研究中,Neubrech等[38]观察到长度为1.5 μm的棒型金纳米天线在中红外波段具有2000以上的近场增强因子(|E|2/|E0|2)。在加入十八烷基硫醇分子前后,对单个纳米天线进行红外透射率测量时,在2900 cm-1附近表现出强烈的振动特征。Bagheri等[39]后来通过研究不同间距的金纳米天线阵列超材料结构(图 6(a)),得到光栅耦合对表面增强生物传感性能的影响。不同于简单的棒型形状,复杂结构的天线可以提供更优的传感性能和更丰富的功能,如同时增强多个振动频带等。例如,Chen等[40]提出了一种用于表面增强光谱的双频设计,该设计将非对称的交叉形状金纳米天线放置在电介质层和金反射层上,实现了双谐振峰增强生物分子吸收的功能。此外,通过使用分形[41]、树突[42]、锥形多偶极子[43]等不同形状的天线设计,可进一步增加谐振峰数量来适用于不同应用场景。

|
图 6 用于表面增强红外吸收的多种金属基超材料(a)棒型纳米天线超材料[39];(b)蝶形天线超材料[44];(c)同轴纳米孔超材料[45];(d)双谐振峰等离子体超材料[46] Fig. 6 Metal-based metamaterials for surface-enhanced infrared absorption (a)rod-type nano antenna metamaterials[39]; (b)bowtie nano antenna metamaterials[44]; (c)coaxial resonator metamaterials[45]; (d)double resonance plasmonicmeta materials[46] |
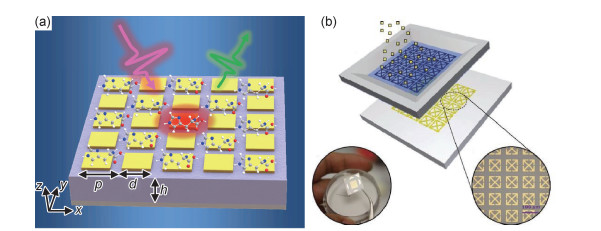
相邻天线单元之间的横向尺寸和几何形状是优化灵敏度的另两个关键参数。例如,与棒型结构相比,由相对的三角形谐振腔组成的蝶形天线超材料结构(图 6(b))可以提供更强的近场[44]。Yoo等[45]将原子层沉积的薄氧化铝层与大面积光刻技术相结合,实现了亚10 nm间隙的共振同轴纳米孔超材料结构(图 6(c))的高通量制备,通过减小天线元件之间的距离获得了更高的灵敏度。SEIRA特别适合研究生物系统,因为它包含了生命基本分子构件中丰富的振动信息。例如,为了检测脂质(约2900 cm-1)和多肽(约1600 cm-1)的特征吸收带,Rodrigo等[46]特别设计了具有双谐振峰的超材料结构,以提供针对这两个波数处的局域表面等离子体共振(图 6(d))。除了化学成分外,生物分子的构象也是研究生物分子相互作用的另一个关键方面。蛋白质是复杂的生物分子机器,只有折叠成正确的构象才能正常工作。为了原位跟踪蛋白质的构象状态,Etezadi等[47]将等离子体超材料生物传感器与微流体通道相结合,捕捉α-核蛋白并对其酰胺Ⅰ带的红外吸收进行测量。2012年,Wu等[48]提出了一种基于法诺共振的非对称超材料结构,基于亚辐射和超辐射等离子体共振之间的干涉,得到了尖锐非对称谱线,并且采用多像素阵列作为传感平台,对纳米尺度的蛋白质分子层及其表面取向进行了多光谱生物传感。
2.2 石墨烯超材料由于金属材料在中红外波段所支持的表面等离激元空间局域性较差、损耗较高、且缺乏可调谐性,在增强生物分子的特征吸收方面,性能仍然不够理想[49]。而石墨烯作为一种新兴的二维碳纳米材料,具有极其优异的光学和电学性能,尤其是在中红外波段可支持低损耗的表面等离激元[50],具有极其紧凑的空间局域性[51],特别适合纳米尺度、微量生物分子振动指纹的检测。而且,石墨烯表面等离激元的谐振性能具有电偏置可调性,为生物分子的选择性检测提供了可能。
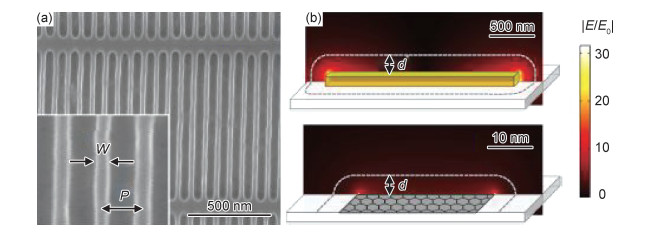
2015年,Rodrigo等[9]详细探讨了石墨烯纳米带阵列超材料结构在中红外波段生物传感中的应用。通过将石墨烯加工成宽度为30 nm、周期为80 nm的光栅结构(图 7(a)),在中红外波段成功激发局域表面等离激元。当器件表面覆盖8 nm厚的蛋白质双分子层(重组蛋白A/G-山羊抗小鼠免疫球蛋白G),谐振峰发生了超过200 cm-1的红移,且在1660 cm-1和1550 cm-1出现蛋白质双分子层的特征吸收峰;尤其当谐振峰接近吸收峰时,蛋白质分子的特征吸收越明显。进一步,作者将金纳米天线与石墨烯纳米带进行对比,表明石墨烯局域表面等离激元在中红外具有更强的局域性(图 7(b))。
|
图 7 用于表面增强红外吸收的石墨烯超材料[9] (a)石墨烯纳米带阵列结构SEM图;(b)金纳米棒(上)和石墨烯带(下)表面等离激元电场局域性对比 Fig. 7 Graphene metamaterials for surface-enhanced infrared absorption[9] (a)SEM image of graphene nanoribbon array; (b)comparison of electric field localization between graphene surface plasmons(below) and gold surface plasmons(upper) |
2016年,Hu等[52]在CaF2纳米薄膜上制备了石墨烯纳米带阵列超材料结构,实现了纳米级分子指纹识别,不仅避免了等离子体-声子杂化作用,而且首次覆盖了整个分子指纹区域(600~1500 cm-1)。2019年,Hu等[53]进一步利用石墨烯表面等离激元的强场约束和气体分子在石墨烯纳米带上的高物理吸附,实现了SO2, NO2,N2O和NO气体分子旋转-振动模式的无标签识别,检测浓度达到800 zmol/μm2。
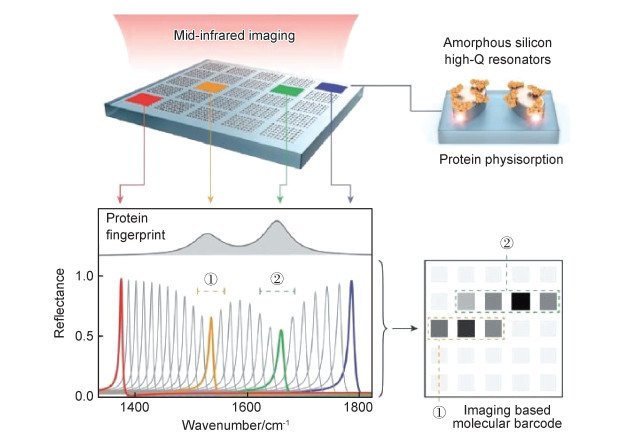
2.3 介质基超表面SEIRA虽然已在多种等离子体超材料中实现,但由于金属欧姆损耗较高,难以实现高品质因数的谐振,所获传感性能远远不够理想;而采用介质基超表面不仅可以产生丰富的电、磁谐振模态,且可有效避免金属损耗的难题。例如,2018年Tittl等[54]利用低损耗的二维像素化介质基超表面,得到一系列具有离散频率的高品质因数反射率曲线,可以在多个光谱点读出分子吸收特征;而且由于谱线干净尖锐,分子吸收特征可由入射光强的变化近似代替,从而可以在不使用光谱仪、不需波长扫描的情况下,得到分子的吸收指纹图像,有望实现高灵敏、多功能的中红外光谱小型化装置,如图 8所示。2019年,Leitis等[55]通过控制不同入射角,实现了介质基超表面电磁场的显著近场增强和共振频率的角度调谐,进而获得了分子指纹成像的角度复用。
太赫兹波位于红外光和微波辐射之间,包含了大量与生物分子(蛋白质、DNA等)振动及转动相关的光谱信息,在其发展之初即受到了广大研究者的重视[56-58]。且与其他光学技术(紫外线、X射线等)相比,它的非侵入性和非电离性允许太赫兹技术被用来检测细胞和组织等更为复杂的结构生物材料,而不必担心热波动或其他非线性副作用的影响[59-60]。然而,由于生物分子在太赫兹波段的吸收截面过小,与电磁波的相互作用较弱,使得光谱信号的变化微弱,给检测带来了很大难度。近年来,为了提高生物传感器的检测灵敏度,基于超材料生物传感芯片的太赫兹检测技术已相继被开发。超材料结构中局域增强的电场可以有效增加分子吸收截面,能够用于碳水化合物、化学混合物、薄样品层和微生物等试样的检测[61-64]。
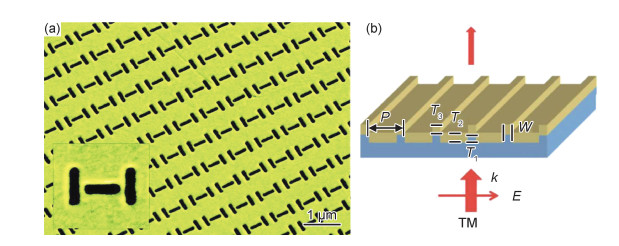
3.1 典型太赫兹超材料生物传感器典型太赫兹超材料生物传感器通常是基于超材料理想吸收体和法诺共振超材料进行实现的。例如,2015年Yahiaoui等[65]报道了一种多通道超材料理想吸收体,用于太赫兹波段无标签生物传感,其频率灵敏度达到了139 GHz/RIU。2016年,Xu等[66]将胶体金属纳米粒子与超材料理想吸收体相结合(图 9(a)),增强了生物分子检测的灵敏度,通过亲和素与金纳米粒子的偶联反应比单独检测亲和素的灵敏度提高了1000倍以上。2019年,Yan等[67]提出了一种基于对称破缺双开口环形谐振器的法诺共振超材料,理论频率灵敏度达到455.7 GHz/RIU。在实际实验中,当口腔癌细胞的浓度从1×105 cells/mL变化到7×105 cells/mL时,频率变化量从50 GHz增大到90 GHz。2020年,Cheng等[68]在25 μm厚的聚酰亚胺基底上制备了非对称开口谐振环法诺共振超材料,在1.13 THz处得到240 GHz/RIU的频率灵敏度。
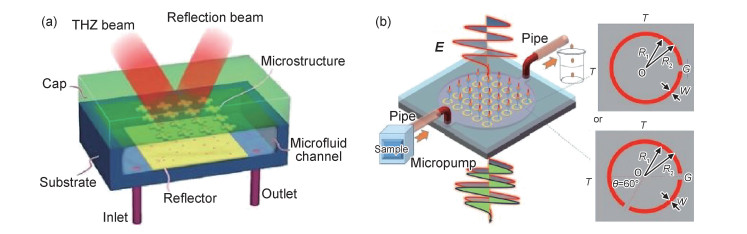
在超材料生物传感器的研究中,人们对于开发适用于现场检测、实用便携的诊断设备的兴趣也日益浓厚[69-71],这些设备对于全球医疗保健、环境监测、食品安全等都有着巨大的应用前景。2011年,Tao等[72]提出了一种纸基平面超材料葡萄糖检测装置(图 9(b)),其葡萄糖检测的灵敏度达到3.0 mmol/L,与人体血液中葡萄糖的正常浓度(3~30 mmol/L)相匹配,表现出很好的实际应用潜力。
太赫兹波对于水分子的强吸收,限制了太赫兹波段超材料生物传感器对于水溶液样品的检测,而与微流体技术结合可以很好地解决这一问题。2008年,Sun等[73]结合微流体技术,制备了适用于50 nm薄液层传感的开口谐振环平面结构阵列,其中电、磁谐振都表现出了红移和透射增强的效果。2016年,Hu等[74]构建了一种微结构阵列-介电层-金属层的三明治结构(10(a)),其中介电层具有的孔洞可作为微流体通道。通过对超材料进行设计可以将电磁场强约束在通道内,从而显著增强了待检测物质与入射太赫兹波之间的相互作用,其频率灵敏度高达3.5 THz/RIU。2017年,Geng等[75]制备了两种与微流体技术集成的太赫兹超材料生物传感器(图 10(b)),用于检测早期肝癌生物标志物的甲胎蛋白(AFP)和谷氨酰胺转移酶同工酶Ⅱ(GGT-Ⅱ)。
环形偶极子是环形多极子的一种,由电流沿着圆环体的子午线表面流动而形成[76]。不同于传统的电偶极子和磁偶极子,环形偶极子具有独特的电磁响应,可以明显减少材料的辐射损耗,从而形成一种高品质因子的光学共振腔-环形偶极子共振腔。这种共振腔模式的激发能够极大地促进光和物质的相互作用,继而实现诸如低阈值半导体激发器、光开发和光调制器等重要的光学器件,且环形偶极子具有很强的电场辐射模式,对环境的扰动极其敏感[77]。
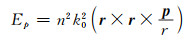
|
(3) |
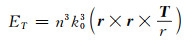
|
(4) |
式(3)和(4)分别比较了传统偶极子和环形偶极子共振散射体的电场辐射。其中,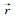
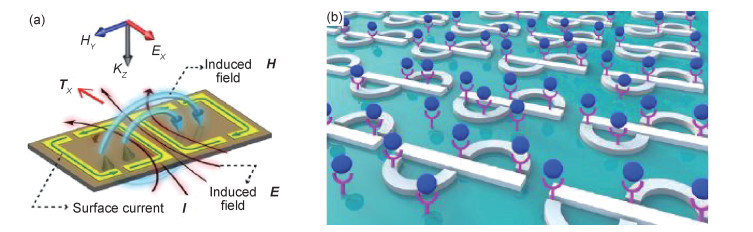
2017年,Gupta等[78]通过在环形谐振器中引入镜像非对称设计(图 11(a)),在临近谐振腔中激发相反磁场形成环形偶极子,实现了太赫兹波段的平面环形超材料,并将其用于折射率生物传感,对于微米尺度薄膜检测最高能够达到186 GHz/RIU的频率灵敏度。2017年,Ahmadivand等[79]设计了一种由铁和钛等两种金属组成的非对称平面等离子体谐振器(图 11(b))来激发太赫兹波段的磁偶极子和环形偶极子,并从实验上证实了该环形偶极子超材料能够检测直径为40 nm的寨卡病毒包膜蛋白(ZIKV,分子量为13000 g/moL)。2018年,该作者进一步研究发现,将胶体金纳米粒子与环形偶极子超材料结合,器件的折射率灵敏度提高了2个数量级,为环形偶极子超材料生物传感器的实际应用提供了可能[80]。
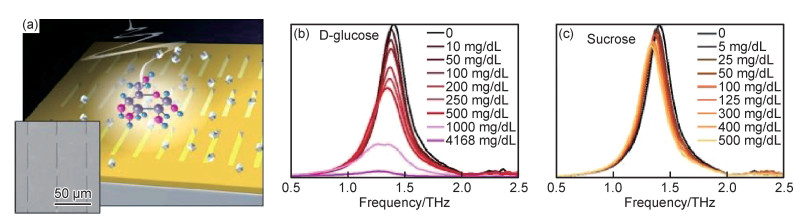
太赫兹波对应着生物大分子(如蛋白质、DNA等)分子内和分子间的振动模式,可以用于选择性生物传感。2015年,Lee等[61]报道了一种由金纳米凹槽天线阵列组成的超材料结构(图 12(a)),能够选择性地对碳水化合物进行高灵敏检测。该超材料传感平台具有很强的电场局域性和太赫兹波透射增强特性,可以有效地提高分子的吸收。当碳水化合物分子的吸收峰与纳米天线的谐振峰相匹配时,目标分子的吸收得到增强,使得在低浓度下依然能够进行目标分子的选择性检测。例如,在1.4 THz附近,额外加入的D-葡萄糖分子对透射峰强度有明显的阻尼作用,而蔗糖对透射峰强度的阻尼作用不明显(图 12(b), (c))。
本文按照工作频率分类,分别总结了可见光与近红外、中红外以及太赫兹波段超材料生物传感器的研究进展,包括折射率生物传感、表面增强拉曼散射、表面增强红外吸收以及太赫兹生物传感等。超材料生物传感器能够支持丰富的电磁模态,具有比传统光学生物传感器更加优异的灵敏度,且易于小型化和集成化,在功能的设计上具有极大的灵活性,是发展下一代高性能生物传感芯片的重要方案之一。
对于超材料生物传感器未来的发展趋势,应该从以下几方面入手:(1)探索新的传感机理(如环形偶极子超材料的引入),进一步提高器件灵敏度;(2)超材料多功能生物传感器的设计(如中红外波段生物分子指纹成像检测),实现多功能集成;(3)低成本、一次性使用的超材料生物传感器设计(如纸基平面超材料),方便个人的临床诊断;(4)结合人工智能技术,实现高通量智能化生物分子检测等。
综上所述,超材料灵活的结构设计和丰富的电磁模态,为生物传感器赋予了更多的可能性,将在未来小型化、集成化的高性能生物传感芯片中发挥重要作用。
| [1] |
SMITH D R, PENDRY J B, WILTSHIRE MC K. Metamaterials and negative refractive index[J]. Science, 2004, 305(5685): 788-792. DOI:10.1126/science.1096796 |
| [2] |
PENDRY J B. Negative refraction makes a perfect lens[J]. Phys Rev Lett, 2000, 85(18): 3966. DOI:10.1103/PhysRevLett.85.3966 |
| [3] |
PENDRY J B, SCHURIG D, SMITH D R. Controlling electromagnetic fields[J]. Science, 2006, 312(5781): 1780-1782. DOI:10.1126/science.1125907 |
| [4] |
HUANG B, BABCOCK H, ZHUANG X. Breaking the diffraction barrier: super-resolution imaging of cells[J]. Cell, 2010, 143(7): 1047-1058. DOI:10.1016/j.cell.2010.12.002 |
| [5] |
DE A F, GENTILE F, MECARINI F, et al. Breaking the diffusion limit with super-hydrophobic delivery of molecules to plasmonic nanofocusing SERS structures[J]. Nat Photonics, 2011, 5(11): 682-687. DOI:10.1038/nphoton.2011.222 |
| [6] |
BROLO A G. Plasmonics for future biosensors[J]. Nat Photonics, 2012, 6(11): 709-713. DOI:10.1038/nphoton.2012.266 |
| [7] |
TSENG M L, JAHANI Y, LEITIS A, et al. Dielectric metasurfaces enabling advanced optical biosensors[J]. ACS Photonics, 2020. |
| [8] |
JEONG J W, ARNOB M M P, BAEK K M, et al. 3D cross-point plasmonic nanoarchitectures containing dense and regular hot spots for surface-enhanced Raman spectroscopy analysis[J]. Adv Mater, 2016, 28(39): 8695-8704. DOI:10.1002/adma.201602603 |
| [9] |
RODRIGO D, LIMAJ O, JANNER D, et al. Mid-infrared plasmonicbiosensing with graphene[J]. Science, 2015, 349(6244): 165-168. DOI:10.1126/science.aab2051 |
| [10] |
FANO U. Effects of configuration interaction on intensities and phase shifts[J]. Phys Rev, 1961, 124(6): 1866-1878. DOI:10.1103/PhysRev.124.1866 |
| [11] |
FAN J A, BAO K, WU C, et al. Fano-like interference in self-assembled plasmonic quadrumer clusters[J]. Nano Lett, 2010, 10(11): 4680-4685. DOI:10.1021/nl1029732 |
| [12] |
LIU N, WEISS T, MESCH M, et al. Planar metamaterial analogue of electromagnetically induced transparency for plasmonic sensing[J]. Nano Lett, 2010, 10(4): 1103-1107. DOI:10.1021/nl902621d |
| [13] |
MORITAKE Y, KANAMORI Y, HANE K. Experimental demonstration of sharp Fano resonance in optical metamaterials composed of asymmetric double bars[J]. Opt Lett, 2014, 39(13): 4057-4060. DOI:10.1364/OL.39.004057 |
| [14] |
ZHANG S, BAO K, HALAS N J, et al. Substrate-induced Fano resonances of a plasmonic nanocube: a route to increased-sensitivity localized surface plasmon resonance revealed[J]. Nano Lett, 2011, 11(4): 1657-1663. DOI:10.1021/nl200135r |
| [15] |
SHEN Y, ZHOU J, LIU T, et al. Plasmonic gold mushroom arrays with refractive index sensing figures of merit approaching the theoretical limit[J]. Nat Commun, 2013, 4(1): 1-9. |
| [16] |
LEE K L, WU S H, LEE C W, et al. Sensitive biosensors using Fano resonance in single gold nanoslit with periodic grooves[J]. Opt Express, 2011, 19(24): 24530-24539. DOI:10.1364/OE.19.024530 |
| [17] |
LEE K L, HUANG J B, CHANG J W, et al. Ultrasensitive biosensors using enhanced Fano resonances in capped gold nanoslit arrays[J]. Sci Rep, 2015, 5: 8547. DOI:10.1038/srep08547 |
| [18] |
HUO P, ZHANG S, LIANG Y, et al. Hyperbolic metamaterials and their applications[J]. Adv Opt Mater, 2019, 7(14): 1801616. DOI:10.1002/adom.201801616 |
| [19] |
KABASHIN A V, EVANS P, PASTKOVSKY S, et al. Plasmonic nanorod metamaterials for biosensing[J]. Nat Mater, 2009, 8(11): 867-871. DOI:10.1038/nmat2546 |
| [20] |
SREEKANTH K V, ALAPAN Y, ELKABBASH M, et al. Extreme sensitivity biosensing platform based on hyperbolic metamaterials[J]. Nat Mater, 2016, 15(6): 621. DOI:10.1038/nmat4609 |
| [21] |
SREEKANTH K V, ALAPAN Y, ELKABBASH M, et al. Enhancing the angular sensitivity of plasmonic sensors using hyperbolicmetamaterials[J]. Adv Opt Mater, 2016, 4(11): 1767-1772. DOI:10.1002/adom.201600448 |
| [22] |
KRAVETS V G, SCHEDIN F, JALIL R, et al. Singular phase nano-optics in plasmonic metamaterials for label-free single-molecule detection[J]. Nat Mater, 2013, 12(4): 304-309. DOI:10.1038/nmat3537 |
| [23] |
MALASSIS L, MASSE P, TREGUER-DELAPIERRE M, et al. Topological darkness in self-assembled plasmonic metamaterials[J]. Adv Mater, 2014, 26(2): 324-330. DOI:10.1002/adma.201303426 |
| [24] |
FLEISCHMANN M, HENDRA P J, MCQUILLAN A J. Raman spectra of pyridine absorbed at a silver electrode[J]. Chem Phys Lett, 1974, 26(2): 163-166. DOI:10.1016/0009-2614(74)85388-1 |
| [25] |
ALBRECHT M G, CREIGHTON J A. Anomalously intense Raman spectra of pyridine at a sliver electrode[J]. Am Chem Soc, 1977, 99(15): 5215-5217. DOI:10.1021/ja00457a071 |
| [26] |
CAO C, ZHANG J, WEN X, et al. Metamaterials-based label-free nanosensor for conformation and affinity biosensing[J]. ACS Nano, 2013, 7(9): 7583-7591. DOI:10.1021/nn401645t |
| [27] |
SHIOI M, JANS H, LODEWIJKS K, et al. Tuning the interaction between propagating and localized surface plasmons for surface enhanced Raman scattering in water for biomedical and environmental applications[J]. Appl Phys Lett, 2014, 104(24): 243102. DOI:10.1063/1.4883743 |
| [28] |
GUDDALA S, RAO D N, RAMAKRISHNA S A. Resonant enhancement of Raman scattering in metamaterials with hybrid electromagnetic and plasmonic resonances[J]. Opt, 2016, 18(6): 065104. |
| [29] |
CHU Y, BANEE M G, CROZIER K B. Double-resonance plasmon substrates for surface-enhanced Raman scattering with enhancement at excitation and stokes frequencies[J]. ACS Nano, 2010, 4(5): 2804-2810. DOI:10.1021/nn901826q |
| [30] |
JIAO Y, RYCKMAN J D, KOKTYSH D S, et al. Controlling surface enhanced Raman scattering using grating-type patterned nanoporous gold substrates[J]. Opt Mater Express, 2013, 3(8): 1137-1148. DOI:10.1364/OME.3.001137 |
| [31] |
ZHANG X, ZHENG Y, LIU X, et al. Hierarchical porous plasmonic metamaterials for reproducible ultrasensitive surface-enhanced Raman spectroscopy[J]. Adv Mater, 2015, 27(6): 1090-1096. DOI:10.1002/adma.201404107 |
| [32] |
GRIFFITHS P R, DE H J A. Fourier transform infrared spectrometry[M]. New York: John Wiley & Sons Inc, 2007: 1-18.
|
| [33] |
BAGRI A, MATTEVI C, ACIK M, et al. Structural evolution during the reduction of chemically derived graphene oxide[J]. Nature Chem, 2010, 2(7): 581-587. DOI:10.1038/nchem.686 |
| [34] |
GARCZAREK F, GERWERT K. Functional waters in intraprotein proton transfer monitored by FTIR difference spectroscopy[J]. Nature, 2006, 439(7072): 109-112. DOI:10.1038/nature04231 |
| [35] |
NEUBRECH F, HUCK C, WEBER K, et al. Surface-enhanced infrared spectroscopy using resonant nanoantennas[J]. Chem Rev, 2017, 117(7): 5110-5145. DOI:10.1021/acs.chemrev.6b00743 |
| [36] |
DONG L, YANG X, ZHANG C, et al. Nanogapped Au antennas for ultrasensitive surface-enhanced infrared absorption spectroscopy[J]. Nano Lett, 2017, 17(9): 5768-5774. DOI:10.1021/acs.nanolett.7b02736 |
| [37] |
NOVOTNY L, Van HULST N. Antennas for light[J]. Nat Photonics, 2011, 5(2): 83-90. DOI:10.1038/nphoton.2010.237 |
| [38] |
NEUBRECH F, PUCCI A, CORNELIUS T W, et al. Resonant plasmonic and vibrational coupling in a tailored nanoantenna for infrared detection[J]. Phys Rev Lett, 2008, 101(15): 157403. DOI:10.1103/PhysRevLett.101.157403 |
| [39] |
BAGHERI S, WEBER K, GISSIBL T, et al. Fabrication of square-centimeter plasmonic nanoantenna arrays by femtosecond direct laser writing lithography: effects of collective excitations on SEIRA enhancement[J]. ACS Photonics, 2015, 2(6): 779-786. DOI:10.1021/acsphotonics.5b00141 |
| [40] |
CHEN K, ADATO R, ALTUG H. Dual-band perfect absorber for multispectral plasmon-enhanced infrared spectroscopy[J]. ACS Nano, 2012, 6(9): 7998-8006. DOI:10.1021/nn3026468 |
| [41] |
AOUANI H, SIPOVA H, RAHMANI M, et al. Ultrasensitive broadband probing of molecular vibrational modes with multifrequency optical antennas[J]. ACS Nano, 2013, 7(1): 669-675. DOI:10.1021/nn304860t |
| [42] |
WALLACE G Q, FOY H C, ROSENDAHL S M, et al. Dendritic plasmonics for mid-infrared spectroscopy[J]. Phys Chem C, 2017, 121(17): 9497-9507. DOI:10.1021/acs.jpcc.7b02039 |
| [43] |
HUGHES T W, FAN S. Plasmonic circuit theory for multiresonant light funneling to a single spatial hot spot[J]. Nano Lett, 2016, 16(9): 5764-5769. DOI:10.1021/acs.nanolett.6b02474 |
| [44] |
DODSON S, HAGGUI M, BACHELOT R, et al. Optimizing electromagnetic hotspots in plasmonic bowtie nanoantennae[J]. PhysChemLett, 2013, 4(3): 496-501. |
| [45] |
YOO D, MOHRD A, VIDAL-CODINA F, et al. High-contrast infrared absorption spectroscopy via mass-produced coaxial zero-mode resonators with sub-10 nm gaps[J]. Nano Lett, 2018, 18(3): 1930-1936. DOI:10.1021/acs.nanolett.7b05295 |
| [46] |
RODRIGO D, TITTL A, AIT-BOUZIAD N, et al. Resolving molecule-specific information in dynamic lipid membrane processes with multi-resonant infrared metasurfaces[J]. Nat Commun, 2018, 9(1): 2160. DOI:10.1038/s41467-018-04594-x |
| [47] |
ETEZADI D, WARNER Ⅳ J B, LASHUEL H A, et al. Real-time in situ secondary structure analysis of protein monolayer with mid-infrared plasmonicnanoantennas[J]. ACS Sens, 2018, 3(6): 1109-1117. DOI:10.1021/acssensors.8b00115 |
| [48] |
WU C, KHANIKAEV A B, ADATO R, et al. Fano-resonant asymmetric metamaterials for ultrasensitive spectroscopy and identification of molecular monolayers[J]. Nat Mater, 2012, 11(1): 69. DOI:10.1038/nmat3161 |
| [49] |
ZHONG Y, MALAGARI S D, HAMILTON T, et al. Review of mid-infrared plasmonic materials[J]. Nanophotonics, 2015, 9(1): 093791. DOI:10.1117/1.JNP.9.093791 |
| [50] |
GRIGORENKO A N, POLINI M, NOVOSELOV K S. Graphene plasmonics[J]. Nat Photonics, 2012, 6(11): 749-758. DOI:10.1038/nphoton.2012.262 |
| [51] |
KOPPENS F H L, CHANG D E, GARCIA D A F J. Grapheneplasmonics: a platform for strong light-matter interactions[J]. Nano Lett, 2011, 11(8): 3370-3377. DOI:10.1021/nl201771h |
| [52] |
HU H, YANG X, ZHAI F, et al. Far-field nanoscale infrared spectroscopy of vibrational fingerprints of molecules with graphene plasmons[J]. Nat Commun, 2016, 7(1): 1-8. |
| [53] |
HU H, YANG X, GUO X, et al. Gas identification with graphene plasmons[J]. Nat Commun, 2019, 10(1): 1131. DOI:10.1038/s41467-019-09008-0 |
| [54] |
TITTL A, LEITIS A, LIU M, et al. Imaging-based molecular barcoding with pixelated dielectric metasurfaces[J]. Science, 2018, 360(6393): 1105-1109. DOI:10.1126/science.aas9768 |
| [55] |
LEITIS A, TITTL A, LIU M, et al. Angle-multiplexed all-dielectric metasurfaces for broadband molecular fingerprint retrieval[J]. Sci Adv, 2019, 5(5): 2871. DOI:10.1126/sciadv.aaw2871 |
| [56] |
XIE L, YAO Y, YING Y. The application of terahertz spectroscopy to protein detection: a review[J]. Appl Spectrosc Rev, 2014, 49(6): 448-461. DOI:10.1080/05704928.2013.847845 |
| [57] |
YONEYAMA H, YAMASHITA M, KASAI S, et al. Terahertz spectroscopy of native-conformation and thermally denatured bovine serum albumin (BSA)[J]. Phys Med Biol, 2008, 53(13): 3543. DOI:10.1088/0031-9155/53/13/010 |
| [58] |
ARORA A, LUONG T Q, KRUGER M, et al. Terahertz-time domain spectroscopy for the detection of PCR amplified DNA in aqueous solution[J]. Analyst, 2012, 137(3): 575-579. DOI:10.1039/C2AN15820E |
| [59] |
SHIRAGA K, OGAWA Y, SUZUKI T, et al. Characterization of dielectric responses of human cancer cells in the terahertz region[J]. Infrared Millim Terahertz Waves, 2014, 35(5): 493-502. DOI:10.1007/s10762-014-0067-y |
| [60] |
MENG K, CHEN T, CHEN T, et al. Terahertz pulsed spectroscopy of paraffin-embedded brain glioma[J]. J Biomed Opt, 2014, 19(7): 077001. DOI:10.1117/1.JBO.19.7.077001 |
| [61] |
LEE D K, KANG J H, LEE J S, et al. Highly sensitive and selective sugar detection by terahertz nano-antennas[J]. Sci Rep, 2015, 5(1): 15459. DOI:10.1038/srep15459 |
| [62] |
LEE D K, KIM G, KIM C, et al. Ultrasensitive detection of residual pesticides using THz near-field enhancement[J]. IEEE Trans THz SciTechnol, 2016, 6(3): 389-395. DOI:10.1109/TTHZ.2016.2538731 |
| [63] |
FAN F, CHEN S, LIN W, et al. Magnetically tunable terahertz magnetoplasmons in ferrofluid-filled photonic crystals[J]. ApplPhysLett, 2013, 103(16): 161115. |
| [64] |
PARK S J, HONG J T, CHOI S J, et al. Detection of microorganisms using terahertz metamaterials[J]. Sci Rep, 2014, 4: 4988. |
| [65] |
YAHIAOUI R, TAN S, CONG L, et al. Multispectral terahertz sensing with highly flexible ultrathin metamaterial absorber[J]. Appl Phys, 2015, 118(8): 083103. DOI:10.1063/1.4929449 |
| [66] |
XU W, XIE L, ZHU J, et al. Gold nanoparticle-based terahertz metamaterial sensors: mechanisms and applications[J]. ACS Photonics, 2016, 3(12): 2308-2314. DOI:10.1021/acsphotonics.6b00463 |
| [67] |
YAN X, YANG M, ZHANG Z, et al. The terahertz electromagnetically induced transparency-like metamaterials for sensitive biosensors in the detection of cancer cells[J]. Biosens Bioelectron, 2019, 126: 485-492. DOI:10.1016/j.bios.2018.11.014 |
| [68] |
CHENG R, XU L, YU X, et al. High-sensitivity biosensor for identification of protein based on terahertz Fano resonance metasurfaces[J]. Opt Commun, 2020, 473: 125850. DOI:10.1016/j.optcom.2020.125850 |
| [69] |
CHIN C D, LINDER V, SIA S K. Lab-on-a-chip devices for global health: past studies and future opportunities[J]. Lab on a Chip, 2007, 7(1): 41-57. DOI:10.1039/B611455E |
| [70] |
YAGER P, EDWARDS T, FU E, et al. Microfluidic diagnostic technologies for global public health[J]. Nature, 2006, 442(7101): 412-418. DOI:10.1038/nature05064 |
| [71] |
GARDENIERS J G E, VAN D B A. Lab-on-a-chip systems for biomedical and environmental monitoring[J]. Anal BioanalChem, 2004, 378(7): 1700-1703. DOI:10.1007/s00216-003-2435-7 |
| [72] |
TAO H, CHIEFFO L R, BRENCKLE M A, et al. Metamaterials on paper as a sensing platform[J]. Adv Mater, 2011, 23(28): 3197-3201. DOI:10.1002/adma.201100163 |
| [73] |
SUN Y, XIA X, FENG H, et al. Modulated terahertz responses of split ring resonators by nanometer thick liquid layers[J]. Appl Phys Lett, 2008, 92(22): 221101. DOI:10.1063/1.2939215 |
| [74] |
HU X, XU G, WEN L, et al. Metamaterial absorber integrated microfluidic terahertz sensors[J]. Laser Photonics Rev, 2016, 10(6): 962-969. DOI:10.1002/lpor.201600064 |
| [75] |
GENG Z, ZHANG X, FAN Z, et al. A route to terahertz metamaterial biosensor integrated with microfluidics for liver cancer biomarker testing in early stage[J]. Sci Rep, 2017, 7(1): 16378. DOI:10.1038/s41598-017-16762-y |
| [76] |
PAPASIMAKIS N, FEDOTOV V A, SAVINOV V, et al. Electromagnetic toroidal excitations in matter and free space[J]. Nat Mater, 2016, 15(3): 263. DOI:10.1038/nmat4563 |
| [77] |
AHMADIVAND A, GERISLIOGLU B, AHUJA R, et al. Terahertz plasmonics: the rise of toroidalmeta devices towards immunobiosensings[J]. Mater Today, 2020, 32: 108-130. DOI:10.1016/j.mattod.2019.08.002 |
| [78] |
GUPTA M, SRIVASTAVA Y K, MANJAPPA M, et al. Sensing with toroidal metamaterial[J]. Appl Phys Lett, 2017, 110(12): 121108. DOI:10.1063/1.4978672 |
| [79] |
AHMADIVAND A, GERISLIOGLU B, MANICKAM P, et al. Rapid detection of infectious envelope proteins by magnetoplasmonictoroidalmetasensors[J]. ACS Sens, 2017, 2(9): 1359-1368. DOI:10.1021/acssensors.7b00478 |
| [80] |
AHMADIVAND A, GERISLIOGLU B, TOMITAKA A, et al. Extreme sensitive metasensor for targeted biomarkers identification using colloidal nanoparticles-integrated plasmonic unit cells[J]. Biomed Opt Express, 2018, 9(2): 373-386. DOI:10.1364/BOE.9.000373 |
 2021, Vol. 49
2021, Vol. 49