文章信息
- 司子彦, 谢水波, 朱奥琦, 王国华, 刘迎九, 莫官海
- SI Zi-yan, XIE Shui-bo, ZHU Ao-qi, WANG Guo-hua, LIU Ying-jiu, MO Guan-hai
- 蒙脱土/Fe3O4/腐殖酸复合材料对U(Ⅵ)的作用机制
- Action mechanism of montmorillonite/Fe3O4/ humic acid composite on U(Ⅵ)
- 材料工程, 2021, 49(3): 158-166
- Journal of Materials Engineering, 2021, 49(3): 158-166.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2019.001155
-
文章历史
- 收稿日期: 2019-12-01
- 修订日期: 2020-07-10
2. 南华大学 污染控制与资源化技术湖南省重点实验室, 湖南 衡阳 421000
2. Hunan Provincial Key Laboratory of Pollution Control and Resources Technology, University of South China, Hengyang 421000, Hunan, China
铀矿的开采以及核工业的发展所产生的大量低浓度含铀废水,已危害人类健康和生态环境[1]。目前,处理溶液中铀的方法主要有物理法、化学法、生物法等,但有些方法易产生二次污染[2-3]。由于吸附法具有成本低、效率高、不易造成二次污染等优点,所以备受研究者的青睐。但是吸附剂的选择至关重要,目前国内外常见的吸附剂有矿物类吸附剂(蒙脱石、高岭土等)、纳米材料(纳米零价铁)及炭类材料(生物炭)等[4]。
纳米Fe3O4颗粒是具有磁分离性,且含丰富活性位点的一种潜力巨大的吸附材料。研究表明了Fe3O4对重金属离子具有较强的吸附能力[5],但纳米Fe3O4颗粒易氧化,会导致磁性的损失。腐殖酸(HA)与Fe3O4纳米粒子之间具有很高的亲和力,包裹HA的Fe3O4纳米粒子能够防止其被氧化,增强Fe3O4纳米粒子的稳定性和吸附能力[6],如Yang等[7]采用化学共沉淀法合成了HA包覆Fe3O4磁性纳米粒子并进行了对Eu(Ⅲ)的去除,吸附量达到了6.95×10-5 mol·g-1;Pallavi等[8]研究HA/Fe3O4对U(Ⅵ)的去除效果,结果表明对U(Ⅵ)的最大吸附量达到10.5 mg·L-1。此外纳米Fe3O4粒子具有易团聚[9]和难分散的缺点[10],但是将纳米Fe3O4颗粒负载在蒙脱土(MMT)上可解决此问题[11]。万栋等[12]将蒙脱土(MMT)与磁性纳米Fe3O4相结合,证实纳米Fe3O4的分散性提高,可以解决易团聚的问题。
本研究将HA与MMT、同时与纳米Fe3O4复合制备出MMT/Fe3O4/HA新型材料(MFH),既利用了Fe3O4的高活性,又避免了其应用上的弊端。通过实验确定MFH对U(Ⅵ)的最佳吸附条件,探讨MFH复合材料对U(Ⅵ)去除机理,为处理低浓度含铀废水提供参考。
1 实验材料与方法 1.1 主要试剂六水合三氯化铁,硫酸亚铁,腐殖酸钠,钠基蒙脱土,氨水,乙醇,U3O8,0.1 mol/L的NaOH和0.1 mol/L的HCl;所有试剂均为分析纯(AR级);实验室用水均为去离子水。
1.2 材料制备制备MFH复合材料[13]:将2.7962 g FeCl3·6H2O,1.9580 g FeSO4·7H2O,一定量的腐殖酸钠和0.3 g MMT溶于体积比为1∶1的乙醇水溶液中,超声处理3 h,在90 ℃下加入一定量的氨水。然后将悬浮液转移到100 mL的聚四氟乙烯的高压反应釜中,120 ℃下恒温2 h后自然冷却,用水和乙醇各洗涤3次,每次洗涤后在离心机中以6000 r/min离心分离5 min,在60 ℃的烘箱中干燥6 h,收集,备用,记为MFH。
1.3 性能测试 1.3.1 静态吸附实验将含有一定浓度铀的溶液装在150 mL锥形瓶中,加入MFH复合材料,调节pH值,在30 ℃,160 r/min的恒温空气浴摇床中震荡1 h进行吸附实验。通过滤纸孔径为2 μm的慢速滤纸过滤,取上清液采用5-二乙氨基苯酚(5-Br-PADAP)分光光度法[14],计算剩余U(Ⅵ)浓度,按式(1)计算U(Ⅵ)的吸附量q(mg/g)和去除率η(%):
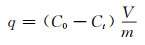
|
(1) |
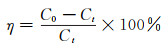
|
(2) |
式中:C0为U(Ⅵ)初始浓度,mg·L-1;Ct为吸附平衡时溶液中U(Ⅵ)的浓度,mg·L-1;V为吸附溶液的体积,L;m为吸附剂的质量,g。
1.3.2 吸附动力学实验在温度为30 ℃,pH值为6,MFH复合材料投加量为0.3 g·L-1,U(Ⅵ)初始浓度分别为5,10,15 mg·L-1的条件下,在30 ℃的恒温振荡器中进行吸附,分别于3,5,10,30,60,120,180 min和240 min取样并过滤。分别用准一级动力学模型(3)、准二级动力学模型(4)以及颗粒内扩散模型(5)对其吸附过程进行拟合,动力学模型方程如下:
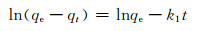
|
(3) |
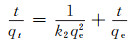
|
(4) |
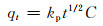
|
(5) |
式中:qt为t时刻吸附量,mg·g-1;k1,k2分别为准一级和准二级动力学吸附常数;t为反应时间,min;qe为平衡吸附容量,mg·g-1;kp为颗粒内扩散常数; C为边界层常数。
1.3.3 吸附等温线实验在温度为30 ℃,pH值为6,MFH复合材料投加量为0.3 g/L的条件下,分别在30,40 ℃和50 ℃的恒温振荡器中吸附1 h,考察吸附温度及U(Ⅵ)初始浓度(0~30 mg/L)等因素对U(Ⅵ)吸附去除的影响。本研究采用了Langmuir模型(式(6))和Freundlich模型(式(7))来进行拟合[15]。表达公式如下:
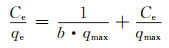
|
(6) |
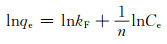
|
(7) |
式中:Ce为吸附平衡后溶液中U(Ⅵ)的浓度,mg·L-1;b为Langmuir吸附平衡常数,L·mg-1;qmax为最大吸附量,mg·g-1;kF为Freundlich吸附平衡常数,mg1-n·Ln·g-1; n为吸附指数。
1.4 MFH复合材料吸附-解吸实验将在温度为30 ℃,MFH投加量为0.2 g·L-1,U(Ⅵ)初始质量浓度5 mg·L-1和吸附时间为120 min的条件下吸附U(Ⅵ)达到平衡后的MFH加入0.1 mol/L的HCl溶液中,30 ℃的恒温摇床中下震荡120 min,取一定体积的吸附液在6000 r/min转速下离心,测定上清液中U(Ⅵ)浓度。将解吸后的MFH用蒸馏水多次洗涤,在真空干燥箱内烘干后重复进行吸附-解吸实验,循环5次,记录U(Ⅵ)的解吸率w(%):
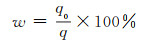
|
(8) |
式中:q0为U(Ⅵ)的解吸量,mg/g;q为U(Ⅵ)的吸附量,mg/g。
2 结果与分析 2.1 MFH复合材料的表征 2.1.1 材料复合前后BET分析Fe3O4/HA与MFH复合材料的比表面积分析结果见表 1。从表 1可知,将Fe3O4/HA负载于蒙脱土上,比表面积在一定程度上增大,这可能是因为纳米Fe3O4/HA颗粒分布在蒙脱土表面,改善了其孔隙结构,从而增大了比表面积。孔体积从0.619 cm3/g增大到0.685 cm3/g,而孔径从1.22 nm减小到1.06 nm。
| Material | Specific surface area/(m2·g-1) | Pore volume/ (cm3·g-1) | Bore diameter/ nm |
| Fe3O4/HA | 84.65 | 0.619 | 1.22 |
| MFH | 110.07 | 0.685 | 1.06 |
图 1为样品的FTIR图谱,可知,在HA的3456 cm-1处对应为O—H拉伸振动,证实了可能是醇/酚以及羧酸的存在[16-17]。1576 cm-1处对应C=O伸缩振动,1382 cm-1处对应—CH2—。而在Fe3O4/HA上3456 cm-1的峰发生了偏移,同时Fe3O4/HA在564 cm-1出现了Fe—O的拉伸振动,说明HA成功包裹在了Fe3O4上,同时又保留HA中的—OH(3413 cm-1),C=O(1626 cm-1)及—CH2—(1388 cm-1)振动峰。在MMT中,3448 cm-1与1639 cm-1对应的是—OH伸缩振动和弯曲振动;1034,913,519 cm-1分别对应Si—O伸缩振动、羟基O—H的变形、Al—O—Si的变形振动[18]。在MFH中,1399 cm-1出现了Fe3O4/HA中—CH2—峰;MMT中519 cm-1对应Al—O—Si的变形振动,在复合后偏移到562 cm-1,说明成功引入Fe—O峰,证明了MFH合成成功。
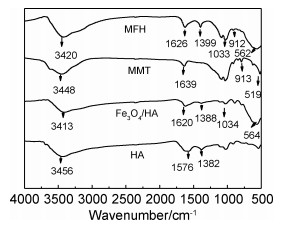
|
图 1 Fe3O4/HA,HA,MMT,MFH的FTIR图谱 Fig. 1 FTIR spectra of Fe3O4/HA, HA, MMT and MFH |
图 2为样品的XRD图谱,可知,Fe3O4/HA在2θ=30.1°,35.8°,62.6°出现特征峰,对应Fe3O4的(220),(311),(440)晶面衍射峰,其中35.8 °衍射峰最强,表示含有铁氧化物[19]。MMT在2θ=21.9°出现特征峰,对应MMT的(101)晶面衍射峰[20]。在MFH复合材料的XRD图谱中,可以看到MMT(2θ=21.9°)和Fe3O4/HA(2θ=35.8°) 的典型衍射峰,且MMT的特征峰明显减弱,可能是Fe3O4/HA负载在MMT上所导致的[6]。
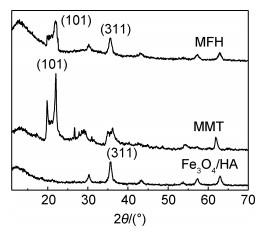
|
图 2 MFH,MMT,Fe3O4/HA的XRD图谱 Fig. 2 XRD patterns of MFH, MMT and Fe3O4/HA |
图 3为复合前后的SEM图,如图 3(a),(b)所示,Fe3O4/HA是很细小的颗粒,而在加入MMT后,MFH出现了明显的波纹结构,波纹结构为MMT的典型形貌[21],在图 3(b)中可以明显地看到分散良好的Fe3O4/HA颗粒,MMT有效地保护着附着在其表面的Fe3O4/HA颗粒,改善了Fe3O4/HA易团聚、易氧化等缺点。

|
图 3 复合前后SEM图 (a)复合前Fe3O4/HA; (b)复合后的MFH Fig. 3 SEM image before and after recombination (a)Fe3O4/HA before recombination; (b)MFH after recombination |
图 4为复合前后的EDS图谱,从图 4(a)可见,Fe3O4/HA中主要含有C,O,Fe等元素,而图 4(b)中MFH中含有C,O,Fe,Al,Si元素,证明Fe3O4/HA与MMT成功复合,MFH合成成功。
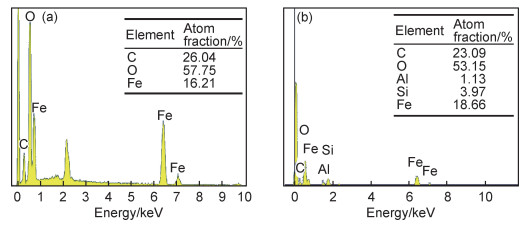
|
图 4 复合前后EDS图谱 (a)复合前Fe3O4/HA; (b)复合后MFH Fig. 4 EDS spectra before and after recombination (a)Fe3O4/HA before recombination; (b)MFH after recombination |
在温度为30 ℃,MFH投加量为0.2 g/L,U(Ⅵ)初始质量浓度为5 mg/L和吸附时间为120 min的条件下,用0.1 mol/L的NaOH和HCl调节pH值分别为2~7,研究pH值对MFH去除U(Ⅵ)的影响,结果如图 5所示,随着pH值的增加,MFH对U(Ⅵ)的吸附量先上升后缓慢下降,在pH值为2~6时,溶液中MFH对U(Ⅵ)的吸附量呈上升趋势,当pH值大于6时,呈下降趋势。这是因为在低pH值下,高浓度的H+与UO22+产生了竞争吸附,占据了吸附剂表面的羟基和羧基基团,减少了对UO22+的吸附;随着pH值增加,H+减少,与U(Ⅵ)的竞争吸附减弱,促使吸附量增加[22]。当pH值继续升高,UO22+水解生成UO2 (OH)3-等离子,从而降低了其对UO22+的吸附[23]。在pH值为6时,MFH对U(Ⅵ)的吸附量达到24.15 mg/g。
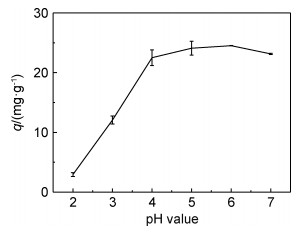
|
图 5 pH值对MFH吸附U(Ⅵ)的影响 Fig. 5 Effect of pH value on U(Ⅵ) adsorption by MFH |
MFH的投加量直接影响其与U(Ⅵ)的活性位点的结合数目,从而影响U(Ⅵ)的吸附效果[24]。在温度为30 ℃,pH值为6,U(Ⅵ)初始质量浓度为5 mg/L和吸附时间为120 min的条件下,研究不同投加量对MFH去除U(Ⅵ)的影响如图 6所示,随着MFH投加量的增加,吸附率逐渐增加并趋向平衡,这是由于随着投加量的增加,吸附剂的活性位点数目相应增加[25],增大了其与U(Ⅵ)结合的机会,因此U(Ⅵ)吸附率增加。当MFH的投加量为0.3 g/L时,吸附率达到了97.7%,吸附量为16.3 mg/g。
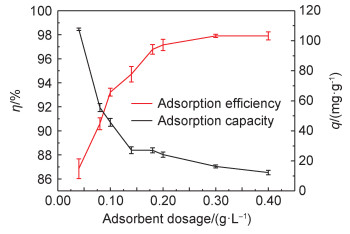
|
图 6 投加量对MFH吸附U(Ⅵ)的影响 Fig. 6 Effect of dosage on U(Ⅵ) adsorption by MFH |
吸附时间对MFH去除U(Ⅵ)效果的影响如图 7所示,在U(Ⅵ)初始浓度为5 mg/L,温度为30 ℃,pH值为6,MFH投加量为0.3 g/L下,MFH对U(Ⅵ)的去除在30 min下达到平衡,平衡时吸附量为24.57 mg/g。
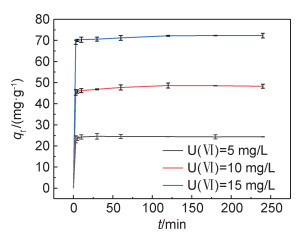
|
图 7 反应时间对MFH吸附U(Ⅵ)效果的影响 Fig. 7 Effect of reaction time on U(Ⅵ) adsorption by MFH |
吸附动力学拟合图如图 8所示,拟合参数见表 2,通过相关系数R2的比较,可以得出准二级动力学方程(R2=0.999~1)比准一级动力学方程(R2=0.443~ 0.963)能够更好地反映MFH对U(Ⅵ)的去除过程,说明U(Ⅵ)与MFH之间作用主要受到表面吸附控制,且实际平衡吸附量与理论值接近[26]。颗粒内扩散模型的拟合数据并不理想,表明MFH吸附U(Ⅵ)的速率主要控制步骤不是颗粒内扩散,还可能涉及其他反应[27](如化学氧化还原[28]),去除过程是由多种机制共同作用的。
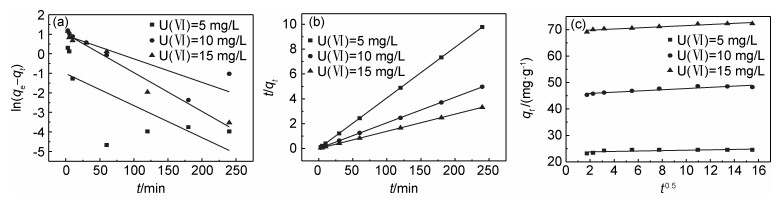
|
图 8 动力学拟合图 (a)准一级动力学拟合曲线;(b)准二级动力学拟合;(c)曲线颗粒内扩散模型 Fig. 8 Kinetic fitting diagrams (a)fitting curves of quasi-first-order kinetic model; (b)fitting curve of quasi-second-order kinetic model; (c)fitting curves of intra-particle diffusion model |
| C0/ (mg·L-1) | qe,exp/ (mg·g-1) | Quasi-first-order kinetic model | Quasi-second-order kinetic model | Intra-particle diffusion model | ||||||||
| k1 | qe, cal | R2 | k2 | qe, cal | R2 | C | kp | R2 | ||||
| 5 | 24.569 | 0.016 | 0.363 | 0.443 | 0.363 | 24.563 | 1.000 | 23.647 | 0.075 | 0.425 | ||
| 10 | 48.633 | 0.012 | 2.566 | 0.725 | 0.045 | 48.497 | 0.999 | 45.436 | 0.230 | 0.852 | ||
| 15 | 72.322 | 0.020 | 2.768 | 0.963 | 0.032 | 72.411 | 0.999 | 69.399 | 0.214 | 0.894 | ||
| Note: qe, exp is the actual adsorption capacity; qe, cal is the theoretical adsorption capacity. | ||||||||||||
图 9为MFH吸附U(Ⅳ)前后的FTIR图谱,对比可知,吸附前后光谱变化不大,仅存在一些峰发生偏移和强度的变化,表明MFH的结构和表面官能团在吸附过程中没有被破坏。[O=U=O]2+吸收峰出现在922 cm-1的位置,这表明U(Ⅵ)成功地被MFH吸附。吸附后3420 cm-1的特征吸收峰移动到了3421 cm-1,说明—OH基团参与了U(Ⅵ)的吸附。1399 cm-1处的C=C吸收峰减弱,而912 cm-1处的—OH吸附U(Ⅵ)后移动到922 cm-1,这可能是由于—OH与U(Ⅵ)发生络合[6]。526 cm-1处的Fe—O吸附U(Ⅵ) 后移动到了554 cm-1,这可能是因为Fe—O与U(Ⅵ)的相互作用[29]。从吸附前后可以得出,—OH,Fe—O等是MFH去除U(Ⅵ)过程中起主要作用的官能团。
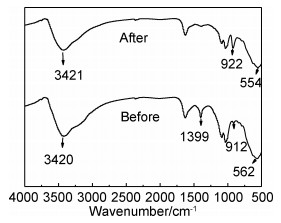
|
图 9 MFH吸附U(Ⅵ)前后的FTIR图谱 Fig. 9 FTIR spectra of MFH before and after adsorption of U(Ⅵ) |
图 10为MFH中各元素吸附U(Ⅵ)前后XPS光谱图,MFH去除U(Ⅵ)前后的XPS分析如图 10(a)所示。MFH的典型峰如100.1 eV时的Si2p峰、72.9 eV时的Al2p峰和285.0 eV时的C1s峰等[30]。吸附U(Ⅵ)之后出现了U4f的特征峰,说明U(Ⅵ)成功地被去除。如图 10(b)所示,在结合能380.4,382.1 eV的U4f7/2峰,结合能在391.5,393.0 eV的U 4f5/2峰,说明去除的铀不仅在氧化状态下以U(Ⅵ)的形式被检测到(382.1 eV和393.0 eV),而且在还原状态下以U(Ⅳ)的形式被检测到(380.4 eV和391.5 eV),表明MFH在去除U(Ⅵ)的过程中发生了化学还原[31]。如图 10(c)所示,C1s的高分辨率光谱中的3个峰285.1,284.4,287.1 eV分别对应C—C/C—H,C—O和O—C=O的特征峰,吸附后这些官能团的结合能都向更高的结合能转变,从而证明这些官能团参与了反应[13]。如图 10(d)所示,反应前在711.0 eV与711.7 eV处为Fe2p3/2的特征峰,723.3 eV与724.8 eV处为Fe2p1/2的特征峰,该特征峰证明存在Fe3O4,这与之前的结论一致。反应前后Fe2+面积从41%减少到36%,Fe3+面积从59%增加到64%,表明有少量Fe2+与U(Ⅵ)发生氧化还原反应,将U(Ⅵ)还原为U(Ⅳ),这与U4f图谱相吻合。
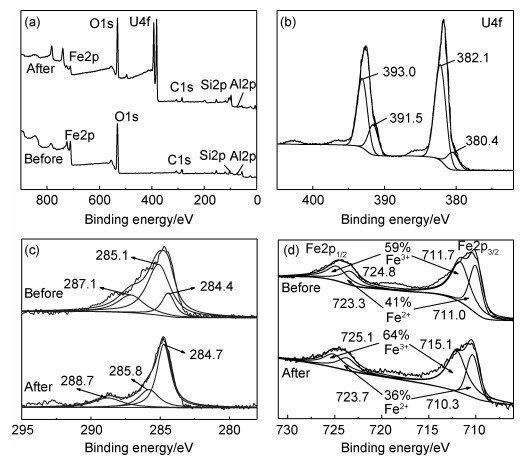
|
图 10 MFH的XPS光谱图 (a)MFH吸附前后XPS图; (b)U4f的XPS图; (c)C1s吸附前后XPS图; (d)Fe吸附前后XPS图 Fig. 10 XPS spectra of MFH (a)XPS spectra before and after MFH adsorption; (b)XPS spectra of U4f;(c)XPS spectra of C1s before and after adsorption; (d)XPS spectra of Fe before and after adsorption |
不同初始浓度对MFH去除U(Ⅵ)效果的影响如图 11所示,在不同温度下,随着U(Ⅵ)初始浓度的增加,MFH对U(Ⅵ)的吸附量增加,但吸附率降低。这是因为当U(Ⅵ)的浓度很低时,由于MFH中存在大量的不饱和吸附位点以及疏松多孔的结构,能够快速吸附U(Ⅵ),所以吸附率较高;然而,随着U(Ⅵ)含量的增加,MFH的活性位点趋于饱和。因此,过量的U(Ⅵ)处于游离水合离子状态,导致吸附速率降低。升高温度,会使分子的运动速率升高,导致传质速率和扩散系数增大,吸附量也随之增加。
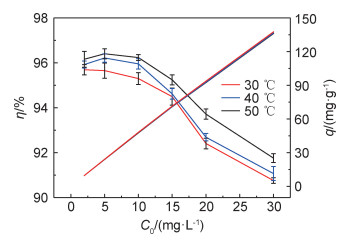
|
图 11 不同U(Ⅵ)初始浓度及温度对MFH吸附U(Ⅵ)的影响 Fig. 11 Effects of initial U(Ⅵ) concentration and temperature on the adsorption of U(Ⅵ) by MFH |
吸附等温线拟合图如图 12所示,拟合参数如表 3所示,Langmuir和Freundlich等温线模型均能很好地对吸附结果进行拟合,表明MFH对U(Ⅵ)的去除过程不是单一的模式,而是单层吸附和多层吸附相结合[32]。但R12>R22,则表明MFH对U(Ⅵ)的去除过程以Langmuir模型为主。在Freundlich等温线模型中,反应吸附程度的特性系数kF与吸附量呈正相关,随着温度的升高,kF增大,说明升高反应温度有利于MFH对溶液中U(Ⅵ)的去除。
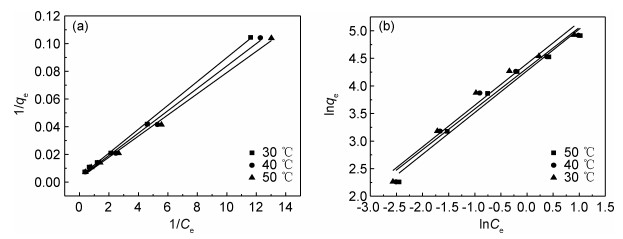
|
图 12 吸附等温线拟合图 (a)Langmuir拟合图; (b)Freundlich拟合图 Fig. 12 Adsorption isotherm fitting diagrams (a)fitting curve of Langmuir; (b)fitting curve of Freundlich |
| T/K | Langmuir | Freundlich | |||||
| qmax/ (mg·g-1) | b/ (L·mg-1) | R12 | kF | n | R22 | ||
| 303 | 269.54 | 0.43 | 0.999 | 71.68 | 1.32 | 0.975 | |
| 313 | 324.67 | 0.38 | 0.994 | 75.12 | 1.35 | 0.965 | |
| 323 | 375.93 | 0.34 | 0.995 | 81.71 | 1.32 | 0.965 | |
吸附-解吸实验是为了了解材料的吸附行为及吸附剂的循环次数,是吸附研究中的一个重要过程。由于在强酸条件下,复合材料的吸附效率最低,因此本实验采用HCl解吸MFH并考察其再生性能。MFH对U(Ⅵ)的吸附-解吸结果如图 13所示,经过5次循环后,MFH对U(Ⅵ)的去除率降低了6.4%,随着循环次数的增加,去除率下降可能有吸附剂本身损耗、比表面积减少以及其官能团数量减少等原因,但去除率仍在90%以上,说明MFH具有较好的循环再生性能。
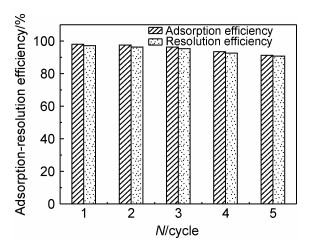
|
图 13 吸附-解吸次数对MFH吸附U(Ⅵ)的影响 Fig. 13 Effect of adsorption-desorption times on adsorption of U(Ⅵ) by MFH |
(1) 利用水热法制备了MFH,通过考察不同因素对MFH去除U(Ⅵ)的影响,在U(Ⅵ)初始浓度为5 mg/L,pH值为6,MFH投加量为0.3 g/L,温度为30 ℃,吸附时间为30 min的条件下,MFH对U(Ⅵ) 的去除率达到了97.7%,最大吸附容量为269.54 mg/g。
(2) MFH对U(Ⅵ)的吸附过程符合准二级动力学模型,说明吸附以化学反应控制;Langmiur和Freundlich吸附等温线模型均能对吸附结果进行很好的拟合,但以Langmiur为主,说明吸附过程以单层吸附为主,同时也存在多层吸附。
(3) 吸附前后的FTIR及XPS表征结果对比表明,—OH,Fe—O,含碳官能团等是MFH吸附U(Ⅵ)过程中起主要作用的官能团,且主要去除机理为络合作用和还原作用。吸附-解吸实验表明MFH具有良好的循环再生性能。
| [1] |
DAN H, LU Y C, QIANG X, et al. Tailored synthesis of SBA-15 rods using different types of acids and its application in adsorption of uranium[J]. Separation and Purification Technology, 2019, 210: 491-496. DOI:10.1016/j.seppur.2018.08.039 |
| [2] |
ZHONG S C, JIAN W, ZENG X P, et al. Synthesis of magnetic Fe3O4/CFA composites for the efficient removal of U(Ⅵ)from wastewater[J]. Chemical Engineering Journal, 2017, 320: 448-457. DOI:10.1016/j.cej.2017.03.074 |
| [3] |
刘红娟, 谢水波, 张希晨, 等. 氧化石墨烯复合材料吸附铀的研究进展[J]. 材料工程, 2018, 46(5): 11-21. LIU H J, XIE S B, ZHANG X C, et al. Research progress of graphene oxide composite materials for uranium adsorption[J]. Journal of Materials Engineering, 2018, 46(5): 11-21. |
| [4] |
刘红娟, 吴仁杰, 谢水波, 等. 氧化石墨烯及其复合材料对水中放射性核素的吸附[J]. 材料工程, 2019, 47(10): 22-32. LIU H J, WU R J, XIE S B, et al. Graphene oxide and its composites for adsorption of radionuclides in water[J]. Journal of Materials Engineering, 2019, 47(10): 22-32. |
| [5] |
CALI E, QI J, PREEDY O, et al. Functionalised magnetic nanoparticles for uranium adsorption with ultra-high capacity and selectivity[J]. Journal of Materials Chemistry A, 2018, 6(7): 3063-3073. DOI:10.1039/C7TA09240G |
| [6] |
KOESNARPADI S, SANTOSA S J, SISWANTA D, et al. Synthesis and characterizatation of magnetite nanoparticle coated humic acid (Fe3O4/HA)[J]. Procedia Environmental Sciences, 2015, 30: 103-108. DOI:10.1016/j.proenv.2015.10.018 |
| [7] |
YANG S T, ZONG P F, REN X M, et al. Rapid and highly efficient preconcentration of Eu(Ⅲ)by core-shell structured Fe3O4@humic acid magnetic nanoparticles[J]. ACS Applied Materials & Interfaces, 2012, 4(12): 6891-6900. |
| [8] |
PALLAVI S H, JHA S K, PANDEY S P, et al. Rapid extraction of uranium from sea water using Fe3O4 and humic acid coated Fe3O4nanoparticles[J]. Journal of Hazardous Materials, 2017, 335: 152-161. DOI:10.1016/j.jhazmat.2017.04.043 |
| [9] |
KALANTARI K. Size-controlled synthesis of Fe3O4 magnetic nanoparticles in the layers of montmorillonite[J]. Journal of Nanomaterials, 2015, 21: 181-190. |
| [10] |
ZHANG P, MO Z L, HAN L J, et al. Preparation and photocatalytic performance of magnetic TiO2/montmorillonite/Fe3O4 nanocomposites[J]. Industrial & Engineering Chemistry Research, 2014, 53(19): 8057-8061. |
| [11] |
MAHDAVINIA G R, HASANPOUR S, BEHROUZI L. Study on adsorption of Cu(Ⅱ) on magnetic starch-g-polyamidoxime/montmorillonite/Fe3O4nanocomposites as novel chelating ligands[J]. Starch-Starke, 2015, 68(3): 188-199. |
| [12] |
万栋, 王光华, 李文兵, 等. 不同改性膨润土负载纳米磁性Fe3O4的制备及表征[J]. 工业安全与环保, 2014, 40(9): 27-29. WAN D, WANG G H, LI W B, et al. Preparation and characterization of supported Fe3O4 nanoparticles with different modified bentonite[J]. Industrial Safety and Environmental Protection, 2014, 40(9): 27-29. |
| [13] |
LU H J, WANG J K, LI F, et al. Highly efficient and reusable montmorillonite/Fe3O4/humic acid nanocomposites for simultaneous removal of Cr(Ⅵ) and Aniline[J]. Nanomaterials, 2018, 8(7): 537-552. DOI:10.3390/nano8070537 |
| [14] |
高翔, 谢水波, 刘迎久, 等. 壳聚糖-生物炭复合材料对U(Ⅵ)的吸附性能试验研究[J]. 原子能科学技术, 2019, 53(8): 1350-1358. GAO X, XIE S B, LIU Y J, et al. Experimental study on adsorption properties of chitosan biochar composite for U (Ⅵ)[J]. Atomic Energy Science and Technology, 2019, 53(8): 1350-1358. |
| [15] |
SONG W C, LIU M C, HU R, et al. Water-soluble polyacrylamide coated-Fe3O4 magnetic composites for high-efficient enrichment of U(Ⅵ) from radioactive wastewater[J]. Chemical Engineering Journal, 2014, 246: 268-276. DOI:10.1016/j.cej.2014.02.101 |
| [16] |
LI Y J, CHEN H, WU J, et al. Preparation and characterization of APTES modified magnetic MMT capable of using as anisotropic nanoparticles[J]. Applied Surface Science, 2018, 447: 393-400. DOI:10.1016/j.apsusc.2018.03.230 |
| [17] |
LI L, WEI Z, LI Z Y, et al. Kinetic and thermodynamic studies on the adsorption of U(Ⅵ) onto humic acid[J]. Desalination & Water Treatment, 2015, 54(9): 2541-2545. |
| [18] |
XU Z X, LV F Z, ZHANG Y, et al. Synthesis and characterization of CPC modified magnetic MMT capable of using as anisotropic nanoparticles[J]. Chemical Engineering Journal, 2013, 215: 755-762. |
| [19] |
ZHAO D L, ZHANG Q, XUAN H, et al. EDTA functionalized Fe3O4/graphene oxide for efficient removal of U(Ⅵ) from aqueous solutions[J]. Journal of Colloid & Interface Science, 2017, 506: 300-307. |
| [20] |
陈宇飞, 楚洪月, 汪波涛. 改性蒙脱土/双马来酰亚胺复合材料微观形貌及力学性能[J]. 复合材料学报, 2018, 35(6): 53-59. CHEN Y F, CHU H Y, WANG B T. Micro-morphology and mechanical properties of modified montmorillonite/bismaleimide composite[J]. Acta Materiae Compositae Sinica, 2018, 35(6): 53-59. |
| [21] |
HUO M Y, GUO H G, JIANG Y S, et al. A facile method of preparing sandwich layered TiO2 in between montmorillonite sheets and its enhanced UV-light photocatalytic activity[J]. Journal of Photochemistry & Photobiology A Chemistry, 2018, 358: 121-129. |
| [22] |
El-MAGHRABI H, YOUNES A A, SALEM A, et al. Magnetically modified hydroxyapatite nanoparticles for the removal of uranium(Ⅵ): preparation, characterization and adsorption optimization[J]. Journal of Hazardous Materials, 2019, 378: 120703-120713. DOI:10.1016/j.jhazmat.2019.05.096 |
| [23] |
LI X L, SONG Q, LIU B J. Adsorption of uranium by carbon materials from aqueous solutions[J]. Progress in Chemistry, 2011, 23(7): 1446-1453. |
| [24] |
ZHANG R, CHEN C L, LI J, et al. Preparation of montmorillonite@carbon composite and its application for U(Ⅵ) removal from aqueous solution[J]. Applied Surface Science, 2015, 349: 129-137. DOI:10.1016/j.apsusc.2015.04.222 |
| [25] |
AYTAS S, YURTLU M, DONAT R. Adsorption characteristic of U(Ⅵ) ion onto thermally activated bentonite[J]. Journal of Hazardous Materials, 2015, 172(2/3): 667-674. |
| [26] |
YANG L F, LIU S R, QIU Y. Preparation of iron-loaded activated carbon and its adsorption properties of uranium ions in aqueous solution[J]. Journal of Engineering, 2016, 16(4): 706-713. |
| [27] |
ZHU K R, CHEN C L. In-situ carbothermal reduction synthesis of Fe and reduction[J]. Chemical Engineering Journal, 2018, 331: 395-405. DOI:10.1016/j.cej.2017.08.126 |
| [28] |
WU J, ZHU H S, LIU G, et al. Fabrication of core-shell CMNP@PmPD nanocomposite for efficient As(Ⅴ) adsorption and reduction[J]. ACS Sustainable Chemistry & Engineering, 2017, 5(5): 4399-4407. |
| [29] |
ZONG P F, WANG S F, ZHAO Y L, et al. Synthesis and application of magnetic graphene/iron oxides composite for the removal of U(Ⅵ) from aqueous solutions[J]. Chemical Engineering Journal, 2013, 220: 45-52. DOI:10.1016/j.cej.2013.01.038 |
| [30] |
ZHENG X M, DOU J F, YUAN J, et al. Removal of Cs+ from water and soil by ammonium-pillared montmorillonite/Fe3O4 composite[J]. Journal of Environmental Sciences, 2017, 56(6): 12-24. |
| [31] |
KUSHWAHA S, SREEDHAR B, PADMAJA P. XPS, EXAFS, and FTIR as tools to probe the unexpected adsorption-coupled reduction of U(Ⅵ) to U(Ⅴ)and U(Ⅳ) on Borassus flabellifer-based adsorbents[J]. Langmuir, 2012, 28(46): 16038-16048. DOI:10.1021/la3013443 |
| [32] |
于长江, 董心雨, 王苗, 等. 海藻酸钙/生物炭复合材料的制备及其对Pb(Ⅱ)的吸附性能和机制[J]. 环境科学, 2018, 39(8): 3719-3728. YU C J, DONG X Y, WANG M, et al. Preparation and characterization of a calcium alginate/biochar microsphere and its adsorption characteristics and mechanisms for Pb(Ⅱ)[J]. Environment Science, 2018, 39(8): 3719-3728. |
 2021, Vol. 49
2021, Vol. 49


