文章信息
- 曾静, 武东政, 庄奕超, 赵金保
- ZENG Jing, WU Dong-zheng, ZHUANG Yi-chao, ZHAO Jin-bao
- 镁电池正极材料性能提升策略的研究进展
- Research progress in strategies for improving performance of cathode materials for magnesium batteries
- 材料工程, 2021, 49(2): 10-20
- Journal of Materials Engineering, 2021, 49(2): 10-20.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2020.000357
-
文章历史
- 收稿日期: 2020-04-21
- 修订日期: 2020-07-06
低成本、高能量密度、高安全性的电化学储能设备对大规模储能和动力汽车等领域的发展至关重要[1]。锂离子电池是当前社会广泛使用的电化学储能设备, 但其成本高且存在由锂枝晶引起的潜在安全问题, 限制了其在这些领域的发展, 因此迫切需要发展新的电化学储能体系来满足社会发展的需求。镁电池是近年来发展起来的一种极具潜力的新型电池[2-3]。相比于锂, 镁是更理想的金属负极: (1)镁金属能量密度高(镁3833 mAh·cm-3 vs 锂2046 mAh·cm-3)且电极电位低(-2.37 V vs SHE), 有利于提高电池的能量密度; (2)镁在地壳中储量丰富, 价格约为锂的1/24, 有利于降低电池成本; (3)镁沉积不易产生枝晶, 因此镁电池安全性更高。自2000年Aurbach课题组[4]开发出第一个可充镁电池模型(Mg//Mo6S8)以来, 镁电池逐渐成为新型储能体系的研究热点[5], 但目前仍处于初级研究阶段, 距离商业化仍有很长的路要走。
阻碍镁电池发展的一个关键原因是缺乏合适的正极材料[6-8]。Mg2+半径(0.72 nm)与Li+半径(0.76 nm) 相近, 但其电荷密度高, 在正极材料中扩散时会受到强烈的库仑排斥, 导致动力学过程缓慢[9-10]。因此, 镁电池正极材料的电化学性能往往不理想, 并且很多适用于锂离子电池的电极材料无法在镁电池中正常工作。针对该现状, 如何提升镁电池正极材料的电化学性能是镁电池领域的重点和难点。本文结合该领域最新的研究进展, 对提升正极材料电化学性能的研究策略进行分类与总结, 旨在完善镁电池正极材料研究的指导体系, 促进高性能镁电池的发展。电化学性能的提升策略分为6种, 分别为减小粒径、借助溶剂的屏蔽效应、增大层间距、调控阴离子、开发新结构和发展双离子电池, 以下将分别进行阐述。
1 提升正极材料电化学性能的研究策略 1.1 减小粒径活性物质的粒径对电化学性能影响极大。根据公式τ=L2/D(τ为离子在粒子中的传输时间, L为粒子尺寸, D为粒子扩散系数)可知, 当扩散系数D不变时, 若活性材料的尺寸减小为原来的1/10, 则离子在粒子中的传输时间为原来的1/100。因此, 减小粒径可以大大缩短离子在粒子中的扩散时间, 从而提高电化学性能。该策略是非常有效的提升电极材料电化学性能的方法, 几乎适用于所有的电极材料[11]。
活性材料纳米化是减小粒径最常用的策略。Guo等[12]通过溶胶-凝胶法合成Li4Ti5O12(LTO)前驱体, 并通过控制煅烧条件, 制备了平均粒径为3.3, 7.6, 14.8 nm和25.9 nm的LTO颗粒, 对应的放电比容量分别为175, 175, 68 mAh·g-1和25 mAh·g-1。该结果说明粒径对LTO的嵌镁性能有很大影响, 只有当粒径减小到10 nm以下时, LTO才能表现出理论比容量。Takeuchi课题组[13]通过控制煅烧温度, 制备了平均粒径为11 nm和31 nm的尖晶石相MgMn2O4。通过将MgMn2O4的粒径从31 nm减小到11 nm, 材料的比容量从70 mAh·g-1提升到220 mAh·g-1, 同时展现出更优异的倍率性能, 说明粒径的减小使电化学性能得到了显著的提升。Liu课题组[14]通过石墨烯辅助成核的方法成功制备平均尺寸为100 nm的Mo6S8纳米块, 与传统固相法与熔盐法制备的Mo6S8微米粒子相比, Mo6S8纳米块具有更小的极化电压、更低的过电位。在0.1 C的电流密度下循环, Mo6S8纳米块的比容量约为100 mAh·g-1, 明显优于Mo6S8微米粒子的80 mAh·g-1。该工作说明即使对于Mg2+传输较快的Mo6S8, 活性材料尺寸的减小对于电化学性能的提高也具有明显的作用。制备薄膜电极是减小粒径的另一种策略, 薄膜的厚度可通过制备条件控制。Aurbach课题组[15]制备了一次颗粒的粒径为20~50 nm、厚度为200 nm的α-V2O5薄膜, 在0.5 μA·cm-2 的小电流密度下, α-V2O5的工作电压为2.35 V, 可实现150~180 mAh·g-1的可逆比容量, 库仑效率接近100%。该课题组结合光谱、电镜和XRD等表征手段首次证明了Mg2+在V2O5中可逆嵌入脱出的过程。除了提升活性材料的嵌镁性能外, 减小粒径的另一优势是有效增大活性物质的比表面积, 提升赝电容与双电层电容, 从而提高镁电池的大倍率充放电性能[16]。
减小粒径虽然可以有效提升电极材料的电化学性能, 但该策略并没有从本质上提升Mg2+在正极中的扩散速率, 并且制备纳米颗粒会增加材料的成本、降低电极材料的体积能量密度。因此, 该策略往往作为性能提升的辅助手段。
1.2 增大层间距通过扩大层状化合物层间距可有效拓宽Mg2+传输通道, 促进Mg2+在层间的传输并降低Mg2+的嵌入脱出对晶体结构的破坏, 从而实现快速、可逆的镁储存。该策略被应用于多数层状化合物中, 包括金属硫化物、金属氧化物和其他新型层状材料。
1.2.1 金属硫化物过渡金属硫化物由于优异的电化学性能在电池储能中得到广泛应用[17]。例如, MoS2由于具有独特的层状结构以及优异的电子电导率被广泛应用于锂离子电池、钠离子电池等储能体系, 然而Mg2+在MoS2中扩散速率低, 因此MoS2在镁电池中表现欠佳。2004年, Li等[18]制备了纳米化的MoS2用于嵌镁, 但仅仅实现了2~25 mAh·g-1的比容量, 库仑效率也仅达到10%~40%。但在几个循环后, MoS2的层间距略微增大, 作者猜测层间距的增大对Mg2+的嵌入更有益。2015年, Yao等[19]首次通过理论计算证明扩大材料的层间距可以有效降低Mg2+与主体材料的相互作用, 从而提高Mg2+在固相中的扩散速率。随后以PEO作为插层物质将MoS2层间距由0.615 nm增加到1.45 nm, 在5 mA·g-1的电流密度下循环30周次后保持70 mAh·g-1的比容量。2017年, Jiao等[20]研究发现, 将层状的MoS2用锂盐辅助超声的方法进行剥离形成单层或少层的MoS2片后, 进一步与石墨烯复合(图 1(a)), 不仅可以提高复合材料的电子电导率, 并且石墨烯的引入可将MoS2层间距由0.62 nm增加到0.98 nm, 使得Mg2+更容易在MoS2层间扩散, 从而提高了MoS2的储镁能力。在20 mA·g-1的电流密度下, 能够实现116 mAh·g-1的比容量, 循环50周次后仍能保持在82 mAh·g-1。相较于之前的研究, 该工作通过引入石墨烯插层的方法对MoS2储镁性能的提升更显著。

|
图 1 金属硫化物采用扩大层间距策略的实例 (a)MoS2/石墨烯复合材料的制备过程[20]; (b)CuS和CuS-CTAB的结构示意图[23]; (c)TiS2在不同放电状态下的晶体结构示意图[24] Fig. 1 Examples of metal sulfide adopting the strategy of increasing the layer spacing (a)schematic illustration of the preparation process for MoS2/graphene composites[20]; (b)structural schematic of the as-prepared CuS and CuS-CTAB materials[23]; (c)schematic diagram of crystal structure of TiS2 in different states[24] |
通过扩大钒硫化合物的层间距也可大大提升其嵌镁性能。Jin等[21]通过引入2-乙基己胺合成了具有超大层间距的VS2纳米花, 实现该结构可逆地嵌入脱出Mg2+, 并具有较高的Mg2+扩散速率(10-11~10-12 cm2·s-1), 在100 mA·g-1的电流密度下表现出245 mAh·g-1的高比容量, 并且在1 A·g-1的电流密度下循环6000周次容量仍然能够保持在90 mAh·g-1。而退火煅烧后的VS2, 由于其层间距减小, Mg2+动力学降低, 比容量大大降低。Mai等[22]通过在电解液中引入[BMP]Cl扩大具有链状结构的VS4的链间距离, 使其展现出更高的嵌镁活性。对不同放电阶段的VS4材料进行表征发现, VS4中含有N, Cl和Mg元素, N元素的存在证明发生[BMP]+的插层反应, 拓宽了VS4的链间距; Cl与Mg原子比接近1∶1, 证明该体系中嵌入离子为MgCl+。该策略可实现VS4扩散系数在3.67×10-12~1.12×10-10 cm2·s-1范围内, 在0.5 A·g-1的大电流密度下循环200周次容量保持在78.9 mAh·g-1。扩大层间距的策略在TiS2, CuS中也进一步得到了验证。Zhao等[23]通过CTAB(十六烷基三甲基溴化铵)插层CuS将层间距由0.82 nm扩大至1.3 nm(图 1(b)), 增大了Mg2+的传输路径, 也实现了室温下CuS储镁性能的显著提升。Yao等[24]报道了采用有机离子PY14+对层状金属硫化物TiS2进行插层(图 1(c)), 将层间距由0.569 nm增大到1.086 nm, 并且通过理论计算证明插层后Mg2+在TiS2的扩散能垒从1.06 eV降低到0.51 eV, 而以MgCl+作为活性离子时的扩散能垒降低为0.18 eV。因此该改性材料的储镁性能得到较大提升, 在240 mA·g-1的电流密度下, 初始容量达到160 mAh·g-1, 循环500周次后仍然能够保持在110 mAh·g-1。
1.2.2 金属氧化物V2O5作为正极中的经典材料, 拓宽层间距是常用提升其性能的策略。2017年, Rhodes等[25]报道了用PEO插层V2O5得到层间距增大的V2O5-PEO, 有效降低了Mg2+与V2O5晶格的相互作用, 从而提高了V2O5的储镁性能。同时作者发现, 虽然PEO含量的提高有利于增大V2O5的层间距, 但层间距并不是越大越好。例如, 掺入5.8%(质量分数, 下同)的PEO中Mg2+的扩散系数为4.7×10-11 cm2·s-1, 而掺入20%的PEO中Mg2+扩散系数为2.5×10-12 cm2·s-1。本课题组[26]通过简易的方法制备了Na+插层的Na0.33V2O5, 层间距有效扩大为0.727 nm, 在20 mA·g-1的电流密度下, 能够实现100周次循环后容量保持在120 mAh·g-1。Mai等[27]结合结晶水与离子插层的方法, 首次通过简单的水热法合成纯相的Mn0.04V2O5·H2O并将其应用于镁电池中。预嵌入的Mn2+和H2O作为层间支撑提高了结构的稳定性和层间距, 并且H2O的存在可以起到电荷屏蔽的作用, 二者的协同作用显著提升了该材料的电化学性能, 在50 mA·g-1的电流密度下, 循环100周次仍保持140 mAh·g-1的比容量, 即使在2 A·g-1的大电流密度下, 也能够循环10000周次且容量保持在80 mAh·g-1。该课题组[28]采用类似的思路制备了Mg0.3V2O5·1.1H2O, 也实现了电化学性能的有效提升。
除了V2O5, 该策略也被应用于其他组成的层状钒氧化物中。Mai等[29]在V3O8的层间预嵌入不同的碱金属离子(Li+, Na+和K+), 通过离子预插层手段来提高层间距以及结构在嵌镁后的结构稳定性, 结果表明V3O8的电化学性能由于预嵌入离子的插层均有所提高, 但预嵌入不同离子的V3O8的嵌镁性能有所不同。密度泛函计算(DFT)计算结果表明, 预嵌入离子的扩散能垒K(1.91 eV)>Na(0.64 eV)>Li(0.33 eV), 这意味着嵌入离子半径较大的K+导致V—O单键产生较大的畸变, 致使结构不稳定, 甚至改变了V3O8的层状结构, 因此Mg2+无法正常地嵌入脱出。LiV3O8虽扩散能垒最低, 但结构稳定性差导致循环性能不理想。因此, NaV3O8具有最优的储镁性能, 在100 mA·g-1 的电流密度下, 经过100周次循环后仍能够实现170 mAh·g-1的比容量。Zhang等[30]进一步结合结晶水的作用制备了NaV3O8·1.69H2O, 实现了较为优异的镁储存性能。
考虑到钒资源的昂贵, 研究人员选用更为廉价的材料来与储量丰富的镁资源相匹配组装低成本的镁电池, 我国锰资源储量丰富, 其中α-MnO2是常见的层状电极材料。Matsui等[31]将α-MnO2应用于镁电池并在36 μA·cm-2的电流密度下实现了280 mAh·g-1的容量, 但Mg2+与MnO2主体结构的强相互作用导致材料的循环性能不好。Yagi等[32]制备了K+, H+和TMA+(四甲基铵)插层的α-MnO2, 分别获得层间距为0.7, 0.72 nm和0.97 nm的K-MnO2, H-MnO2和TMA-MnO2。其中TMA-MnO2在水系电解液中具有最优异的电化学性能, 在1 C的电流密度下可以实现120 mAh·g-1的初始容量, 在2 C的电流密度下, 循环500周次后能够保持65 mAh·g-1左右的比容量。
1.2.3 其他层状化合物在层状化合物中, MXene材料由于其超高的电子电导率备受关注[33]。2018年, Yan等[34]首次实现了通过CTAB插层Ti3C2Tx扩大其层间距来实现Mg2+的可逆存储。插层后的Ti3C2Tx层间距由1.32 nm增大到1.52 nm, 这不仅扩大了传输通道, 还降低了Ti3C2Tx层与层之间的相互作用, 从而提高了Ti3C2Tx的储镁性能, 在0.2 A·g-1的电流密度下, 循环250周次能够保持120 mAh·g-1的比容量。Mai等[35]将PA(苯胺)插层VOPO4(0.741 nm)得到具有超大层间距的改性PA-VOPO4(1.424 nm), DFT计算结果表明, MgCl+比Mg2+在PA-VOPO4中具有更小的扩散能垒, 由此推测在该体系中MgCl+为活性离子。
如表 1所示, 在层状化合物中通过引入碱金属离子、有机分子等可以有效地拓宽材料的层间距, 增大Mg2+的扩散通道, 从而有效提高Mg2+在固体材料中的扩散动力学, 甚至促进MgCl+作为活性离子发生嵌入反应。同时, 由于层间的物质在循环时能够稳定存在、起"支撑柱"作用, 有利于增加材料的结构稳定性, 故而该类材料往往能实现良好的循环性能和倍率性能。该策略是目前可行性较大的提高正极材料性能的有效方法, 但适用材料主要为层状材料, 并且引入的插层物质可能会降低电极材料的比容量。
| Material | Filler | Initial interlayer spacing/nm | Interlayer spacing after expanding/nm | Intercalated ion | Ref |
| MoS2 | PEO | 0.615 | 1.45 | Mg2+ | [19] |
| MoS2 | Graphene | 0.62 | 0.98 | Mg2+ | [20] |
| VS2 | 2-ethylhexylamine | 0.573 | 0.993 | Mg2+ | [21] |
| VS4 | [BMP]+ | 0.583 | 1.252 | MgCl+ | [22] |
| CuS | CTAB | 0.82 | 1.3 | Mg2+ | [23] |
| TiS2 | PY14+ | 0.569 | 1.086 | MgCl+ | [24] |
| V2O5 sol | PEO | 1.16 | 1.26 | Mg2+ | [25] |
| V2O5 | Na+ | - | 0.727 | Mg2+ | [26] |
| Mn0.04V2O5·H2O | Mn2+ | - | 1.09 | Mg2+ | [27] |
| Mg0.3V2O5·1.1H2O | Mg2+ | - | 1.19 | Mg2+ | [28] |
| V3O8 | Na+ | - | 0.685 | Mg2+ | [29] |
| α-MnO2 | TMA+ | - | 0.97 | Mg2+ | [32] |
| Ti3C2Tx | CTAB | 1.32 | 1.52 | Mg2+ | [34] |
| VOPO4 | PA | 0.741 | 1.424 | MgCl+ | [35] |
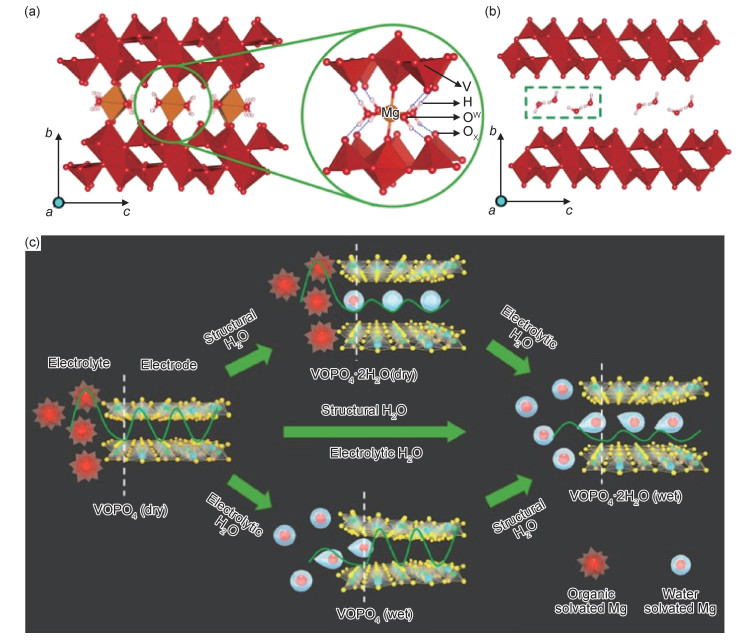
借助溶剂的屏蔽效应提升电化学性能的典型例子为V2O5。1993年, Novák等[36]研究发现, 在1 mol·L-1 Mg(ClO4)2电解液中加入1 mol·L-1 H2O, 商业化V2O5展现出更高的容量, 表明电解液中水的存在有利于提升电化学性能。NováK等[37]进一步研究含结晶水的V2O5·(H2O)y作镁正极材料的电化学性能, 发现含结晶水的V2O5同样能够提升Mg2+在V2O5中可逆嵌入脱出的能力。在此基础上, Zhang等[38]指出电解液中水含量的不同对V2O5嵌镁性能具有影响, 在一定范围内随着水含量的提升, 电化学性能逐步提升。针对以上现象, Ceder等[39]通过DFT计算证明了在含水的电解液中, H2O和Mg2+能够以溶剂化形式共同嵌入V2O5层间(图 2(a), (b)), 从而降低Mg2+的扩散能垒, 提高其嵌入容量, 并且水的引入能够有效地提高该体系的工作电压。然而, 引入的水会与镁负极发生副反应导致镁负极钝化, 因此该方法虽然能够提升V2O5的电化学性能, 但只能实现有限的循环。即使是通过在结构中引入结晶水的手段, 结晶水在循环过程中也可能会部分脱出, 从而影响电化学性能。为解决水与镁负极不兼容的问题, Ceder等[40]首次提出以与镁不反应的二乙二醇二甲醚(G2)溶剂替代水, 同样可以实现溶剂化Mg2+嵌入到V2O5·nH2O, 这一现象由魔角旋转核磁共振谱表征证明。这一工作在拓宽非水溶剂的选择与降低水与Mg副反应方面具有重要意义。
|
图 2 氧化物利用溶剂屏蔽效应的实例 (a)V2O5.H2O在完全嵌镁态的结构示意图[39]; (b)V2O5·H2O在完全脱镁态的结构示意图[39]; (c)VOPO4·nH2O在无水和有水电解液中的电荷储存机制[41] Fig. 2 Examples of metal oxide using solvent shielding effect strategy (a)structures of V2O5·H2O at fully magnesiated state[39]; (b)structures of V2O5·H2O at fully demagnesiated state[39]; (c)schematic of charge storage mechanism of VOPO4·nH2O in dry and wet electrolytes[41] |
除了V2O5之外, 该策略在其他层状化合物材料中也被证明有效。Wang等[41]通过实验与理论计算证明在电解液中引入水或者在VOPO4中引入晶格水都能够有效地提高VOPO4的比容量(图 2(c))。同时, 电解液中水的活度必须大于10-2来平衡VOPO4中的晶格水, 以此来确保Mg2+能够在VOPO4层间进行可逆的嵌入脱出行为。该工作证明了水的引入能够降低镁离子在固相中的扩散能垒并降低溶剂化离子在界面处去溶剂化的能量损失。
Aurbach等[42]通过在层状化合物MnO2的层间引入稳定结晶水的策略, 利用结晶水有效屏蔽了Mg2+与无机主体材料中阴离子骨架之间的静电相互作用, 降低了Mg2+扩散能垒, 同样实现了电化学性能的提高。综上所述, 利用溶剂的屏蔽效应可以有效降低Mg2+与主体材料的相互作用, 实现Mg2+的快速扩散, 从而提升电极材料的嵌镁性能。为避免镁负极与水的副反应, 发展与镁负极兼容的溶剂实现溶剂化Mg2+嵌入反应也是可行的途径。同时, 构建镁电极电解液界面(SEI)膜[43], 实现镁金属在含水电解液中的正常工作, 应受到更多关注。
1.4 阴离子调控Mg2+由于电荷密度高在固体材料中扩散动力学缓慢, 研究结果表明, 过渡金属离子对Mg2+的迁移影响较小, 而Mg2+与阴离子的强相互作用是导致动力学缓慢的关键因素。早在2005年, Aurbach课题组[44]为了理解阴离子是如何影响Mg2+的迁移过程, 对比了同为Chevrel相的Mo6S8和Mo6Se8的储镁行为, 发现Mo6Se8电荷传递阻抗更小, 并且尺寸更大的Se原子能够提供更大的Mg2+传输通道, 因此Mo6Se8具有动力学和热力学的优势。随后, 该课题组[45]深入探究了Mo6S8中不同Se取代量(Mo6S8-ySey, y=0, 1, 2)对电化学性能的影响, 结果表明Se的引入逐渐减弱了Mg2+与主体结构的相互作用, 增加了Mg2+在固相中的扩散动力学, 实现了电化学性能的提高。Wang等[46]进一步通过调控层状化合物MX2(M=Ti和V; X=O, S和Se)中的阴离子(O, S和Se)来研究阴离子对Mg2+动力学的影响, 结果显示TiSe2和VSe2电化学性能优于TiS2和VS2, 并进一步优于TiO2和VO2, 这表明阴离子对Mg2+扩散行为影响很大(图 3), Mg2+在硒化物中具有更快的动力学。硒化物除了由于具有更高的电子电导率、更大的扩散通道外, Se的存在使得Mg2+与主体材料之间的相互作用减弱, 从而有利于电化学性能。2019年, Cao等[47]通过Se部分取代CuS中的S合成了CuS1-xSex(x=0.2)纳米片, 该材料能够在20 mA·g-1的电流密度下实现268 mAh·g-1的容量, 并且在300 mA·g-1 的电流密度下循环100周次容量能够保持在140 mAh·g-1, 倍率性能也优于CuS。通过分析性能提升的根本原因, 作者发现Se的引入不仅可以提升CuS的电子电导率, 还可以起到催化剂的作用, 提升总反应速率和效率。
综上所述, 阴离子调控在提升镁电池电化学性能时起着不可忽视的作用, 采用电负性更弱、半径更大的阴离子有利于减弱Mg2+与主体材料的相互作用, 从而提升其镁电池电化学性能。但Se2-等离子的引入可能会降低电极材料的比容量、增加材料的成本。
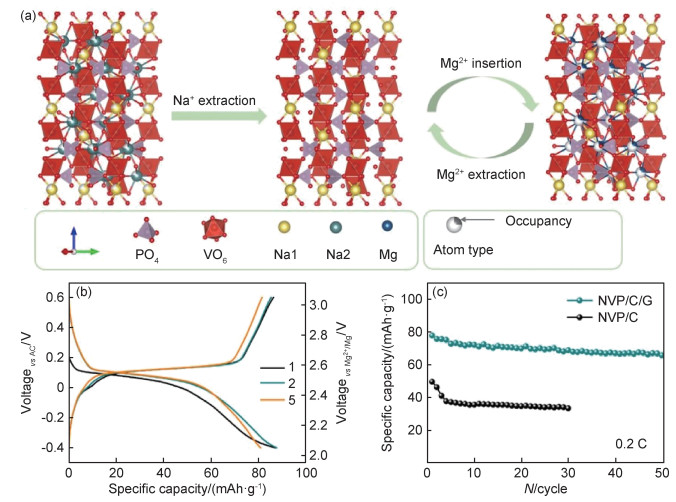
1.5 开发新的结构由于现有电极材料的电化学性能仍不能满足商业化需求, 因此基于新结构提升电化学性能也是必需的。近年来, 人们从结构出发, 将用于嵌钠、锌等离子的电极材料用于嵌镁, 取得了不错的效果[48]。例如, 在高电压正极材料方面, 本课题组[49-50]尝试将具有钠超离子导体(NASICON)结构的Na3V2(PO4)3(NVP)用于嵌镁(图 4), 在干燥的Mg(TFSI)2/AN电解液中进行电化学性能的测试, 结果表明NVP电化学脱钠后的结构NaV2(PO4)3嵌镁电压可达2.5 V, 在0.1 C的电流密度下首周容量为87 mAh·g-1, 并可以在0.2 C的电流密度下循环50周次, 是一种有潜力的高电压正极材料。橄榄石结构的正硅酸盐是有潜力的兼具高比容量与高电压的正极材料。Uchimoto课题组[51]基于Li2FeSiO4通过电化学离子交换法制备了亚稳态的MgFeSiO4, 在三电极体系中比容量超过300 mAh·g-1, 工作电压也达到2.4 V。
|
图 4 NVP的电化学反应机理及电化学性能[50] (a)NVP电化学反应示意图; (b)NVP/C/G在0.1 C下的充放电曲线; (c)NVP/C/G在0.2 C下的循环性能 Fig. 4 Electrochemical reaction mechanism and electrochemical performance of NVP[50] (a)illustration of the electrochemical reaction process of NVP; (b)galvanostatic charge-discharge curves of NVP/C/G at 0.1 C; (c)cycle performance of NVP/C/G at 0.2 C |
发展新的储存机理是提升正极性能的另一有效策略。Ma等[52]通过异价离子掺杂, 在锐钛矿型的TiO2中引入大量的钛空位作为Mg2+的嵌入位点。实验与理论计算的结果表明, Mg2+等多价离子优先嵌入钛空位。相比于原始的TiO2, 掺杂之后容量从25 mAh·g-1提高到165 mAh·g-1, 动力学过程也得到提升。高浓度的空位甚至可以基于空位传输机制消除离子在传输过程中的能垒, 从而有利于多价金属离子传输。该结果表明, 通过缺陷化学来设计用于Mg2+等多价离子电池的电极材料是可行的, 并且基于此有可能开发出大量的适合材料。
开发新结构、基于新机理是提升镁电池正极材料性能的必要途径。但在不断尝试的过程中可能会造成时间与实验成本的浪费。因此, 应加深对Mg2+扩散行为的理解, 为新材料的探索打下基础, 同时应结合理论计算指导结构的筛选和设计, 提高实验效率。
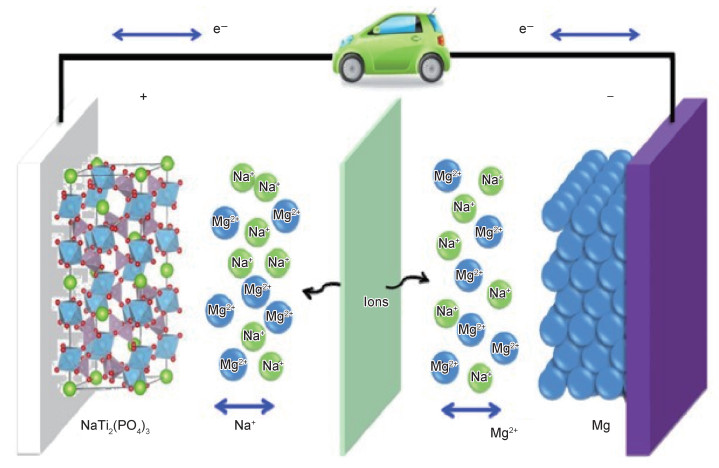
1.6 发展双离子电池与Mg2+在正极材料中的扩散速度相比, Li+, Na+等单价离子的扩散速度要快得多。因此, 在正极一侧以单价金属离子的嵌入脱出取代Mg2+的嵌入脱出反应而负极仍采用金属镁, 构建双离子电池, 可以有效提高正极的动力学过程, 从而发展电化学性能优异的镁电池[53]。双离子电池的工作原理如图 5所示[54], 其中金属镁作为负极、嵌锂/钠材料作为正极材料。从理论上说, 几乎所有适用于锂电、钠电的正极材料都适用于双离子电池。电解液为双离子电池的关键, 其既需要保证金属镁进行可逆的溶解/沉积反应, 又需要具有足量的Li+或Na+保证正极嵌入脱出反应的进行, 因此为含有Mg2+和Li+或Na+的双离子电解液。双离子电池体系既保持了镁金属作为负极无枝晶高安全性的优势, 又具有快速的电极过程动力学, 因此近年来在该方面的研究不断增多。已开发的Li-Mg双离子电池体系, 往往以APC+LiCl溶液为电解液, 如Mg//Mo6S8[55], Mg//TiS2[56]等; 已开发的Na-Mg双离子电池电解液种类较多, 如基于NaBH4+Mg(BH4)2-G2电解液构建的Mg//FeS2[57], Mg//TiS2[58]体系, 基于MgCl2+AlCl3+NaAlCl4-DME电解液构建的高电压Mg//Na3V2(PO4)3[59]体系。
正极的电化学反应是机理研究的重点。Jin课题组[60]构建的Mg//APC+LiCl//VS4双离子电池在500 mA·g-1的电流密度下具有300 mAh·g-1的放电容量, 并且在1000 mA·g-1的电流密度下循环1500周次后仍可以保持110 mA g-1的比容量。机理研究表明, 电化学过程中发生Li+与Mg2+的共嵌入, 容量的贡献主要来源于Mg2+, 放电后反应生成Mg1.40Li0.70VS4, 其中Li+在共嵌入的过程中有利于形成更多扩散通道和结合位点。而在大多数双离子电池体系中, 由于Li+, Na+的扩散速度较快, 因此正极主要为Li+或Na+的嵌入脱出反应。例如, 本课题组[61]通过引入NaBH4作为Mg(TFSI)2电解液的除水剂和Na+源, 设计了一种无氯电解液Mg(TFSI)2+NaBH4-三乙二醇二甲醚(G3)/DME用于Mg//NaTi2(PO4)3双离子电池。在不含NaBH4的电解液中, 电池容量几乎为零。随着NaBH4的浓度逐渐升高, 双离子电池的放电比容量逐渐升高。在10 C的电流密度下, 循环1000周次后仍能保持93 mAh·g-1的放电容量。机理研究证明正极为Na+的嵌入脱出反应。Mai课题组[59]在该体系中采用MgCl2+AlCl3+NaAlCl4-DME电解液, 通过原位XRD等手段也证明了正极为Na+的嵌入脱出反应。
然而, 由于在单价离子嵌入的过程中, 电解液中单价离子的浓度会逐渐降低, 因此需要加入充足的电解液来保证电化学反应的顺利进行。同时, 双盐电解液的质量密度高于传统电解液, 会造成电池整体能量密度的降低及成本的增加。但整体而言, 由于该体系不易产生枝晶, 并且具有与锂电、钠电相近的电极过程动力学, 仍不失为提升镁电池正极动力学过程的一条有效途径。
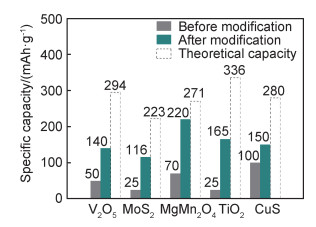
从镁电池正极材料的发展历程来看(图 6), 前期可用于镁电池的正极材料微乎其微, 近年来由于改性策略的兴起与研发技术的提升, 正极材料的探索与改进工作得以大幅度推进。由图 7可知, 经过文中所提到改进策略的优化后, 正极材料的电化学性能得到了较大幅度的提升, 但仍然与理论比容量具有较大差距。
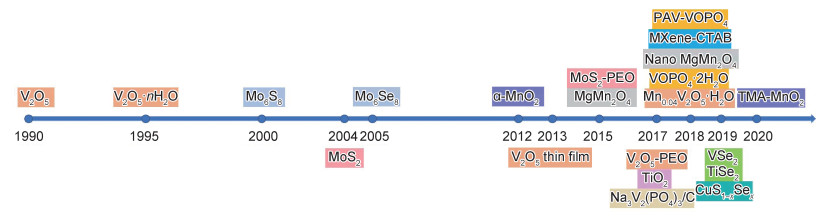
|
图 6 镁电池正极材料发展历程图 Fig. 6 Development course of the cathode material of magnesium battery |
虽然镁电池具有高安全性、低成本的优势, 有望取代锂离子电池在未来大规模储能和动力汽车上应用, 但目前这些优势仍处于理论阶段。近年来, 关于镁电池的研究逐渐增多, 但性能仍不能满足商业化要求, 实现高性能镁电池仍需不断努力。相比于锂离子电池, 镁电池无论是电极材料还是电解液都面临巨大挑战。本文针对正极材料电化学性能差的现状, 总结出6种提升正极电化学性能的策略。目前的研究中通过采用一种或多种手段结合的方式, 实现了正极性能一定程度的提升, 但综合电化学性能仍不够理想, 只有双离子电池可实现快速的正极电化学过程。因此, 提高基于Mg2+嵌入脱出的正极反应速率仍具有很大挑战性。此外, 目前电化学性能相对优异的电极材料往往为工作电压较低的硫化物系列, 而高电压氧化物类正极材料正极动力学过程缓慢。因此, 结合先进的表征手段和计算模型深入理解Mg2+的反应机理与扩散行为, 指导新结构的开发和现有材料的结构设计, 实现性能优异的高电压正极材料的开发非常重要。
另一方面, 要实现高性能镁电池, 电解液和负极也不容忽视。目前, 与镁负极兼容的电解液体系与高电压正极材料不兼容, 且往往以低沸点的醚类为溶剂, 造成电池的安全隐患。而适用于高电压材料的传统电解液体系与镁负极不兼容。因此, 电解液在一定程度上影响了正极材料的发展, 适合于镁金属电池的电解液体系的开发需得到重视。由于传统电解液体系适用于商业化电池, 因此, 高性能镁电池的发展除了要注重正极材料之外, 还需要重视基于传统电解液体系的镁金属电池的发展, 为此镁负极的界面修饰是必要的。
| [1] |
张念, 张逸航. 镁在汽车工业中的应用现状[J]. 中国有色金属, 2019(6): 40-41. ZHANG N, ZHANG Y H. Application status of magnesium in automobile industry[J]. China Nonferrous Metals, 2019(6): 40-41. |
| [2] |
CANEPA P, SAI GAUTAM G, HANNAH D, et al. Odyssey of multivalent cathode materials: open questions and future challenges[J]. Chemical Reviews, 2017, 117(5): 4287-4341. DOI:10.1021/acs.chemrev.6b00614 |
| [3] |
HUIE M M, BOCK D C, TAKEUCHI E S, et al. Cathode materials for magnesium and magnesium-ion based batteries[J]. Coordination Chemistry Reviews, 2015, 287: 15-27. DOI:10.1016/j.ccr.2014.11.005 |
| [4] |
AURBACH D, LU Z, SCHECHTER A, et al. Prototype systems for rechargeable magnesium batteries[J]. Nature, 2000, 407(6805): 724-727. DOI:10.1038/35037553 |
| [5] |
熊碧云. 国外镁电池最新发展[J]. 电源技术, 2012(8): 1250-1251. XIONG B Y. The latest development of foreign magnesium batteries[J]. Chinese Journal of Power Sources, 2012(8): 1250-1251. |
| [6] |
安琴友, 车子璠, 张辰, 等. 多价离子电池的研究现状与前沿[J]. 中国基础科学, 2018(2): 1-6. AN Q Y, CHE Z F, ZHANG C, et al. Research status and frontiers of multivalent ion batteries[J]. China Basic Science, 2018(2): 1-6. |
| [7] |
刘凡凡, 王田甜, 范丽珍. 镁离子电池关键材料研究进展[J]. 硅酸盐学报, 2020, 48(7): 1-16. LIU F F, WANG T T, FAN L Z. Recent development on key materials for rechargeable magnesium batteries[J]. Journal of the Chinese Ceramic Society, 2020, 48(7): 1-16. |
| [8] |
刘渝萍, 谢剑, 李婷婷, 等. 镁-过渡金属复合物正极材料[J]. 化学进展, 2014, 26(9): 1596-1608. LIU Y P, XIE J, LI T T, et al. Development of Mg transition metal complex as cathode materials[J]. Progress in Chemistry, 2014, 26(9): 1596-1608. |
| [9] |
RONG Z, MALIK R, CANEPA P, et al. Materials design rules for multivalent ion mobility in intercalation structures[J]. Chemistry of Materials, 2015, 27(17): 6016-6021. DOI:10.1021/acs.chemmater.5b02342 |
| [10] |
LEVI E, GOFER Y, AURBACH D. On the way to rechargeable Mg batteries: the challenge of new cathode materials[J]. Chemistry of Materials, 2010, 22(3): 860-868. DOI:10.1021/cm9016497 |
| [11] |
CHEN S Q, WU C, SHEN L F, et al. Challenges and perspectives for nasicon-type electrode materials for advanced sodium-ion batteries[J]. Advanced Materials, 2017, 29(48): 1700431. DOI:10.1002/adma.201700431 |
| [12] |
WU N, YIN Y X, GUO Y G. Size-dependent electrochemical magnesium storage performance of spinel lithium titanate[J]. Chemistry- an Asian Journal, 2014, 9(8): 2099-2102. DOI:10.1002/asia.201402286 |
| [13] |
YIN J F, BRADY A B, TAKEUCHI E S, et al. Magnesium-ion battery-relevant electrochemistry of MgMn2O4: crystallite size effects and the notable role of electrolyte water content[J]. Chemical Communications, 2017, 53(26): 3665-3668. DOI:10.1039/C7CC00265C |
| [14] |
CHENG Y W, PARENT L R, SHAO Y Y, et al. Facile synthesis of chevelphase nanocubes and their applications for multivalent energy storage[J]. Chemistry of Materials, 2014, 26(17): 4904-4907. DOI:10.1021/cm502306c |
| [15] |
GERSHINSKY G, YOO H D, GOFER Y, et al. Electrochemical and spectroscopic analysis of Mg2+ intercalation into thin film electrodes of layered oxides: V2O5 and MoO3[J]. Langmuir, 2013, 29(34): 10964-10972. DOI:10.1021/la402391f |
| [16] |
WANG L, ASHEIM K, VULLUM P E, et al. Sponge-like porous manganese(Ⅱ, Ⅲ) oxide as a highly efficient cathode material for rechargeable magnesium ion batteries[J]. Chemistry of Materials, 2016, 28(18): 6459-6470. DOI:10.1021/acs.chemmater.6b01016 |
| [17] |
ZHAO J B, ZHANG Y Y, WANG Y H, et al. The application of nanostructured transition metal sulfides as anodes for lithium ion batteries[J]. Journal of Energy Chemistry, 2018, 27(6): 1536-1554. DOI:10.1016/j.jechem.2018.01.009 |
| [18] |
LI X L, LI Y D. MoS2 nanostructures: synthesis and electrochemical Mg2+ intercalation[J]. The Journal of Physical Chemistry B, 2004, 108(37): 13893-13900. DOI:10.1021/jp0367575 |
| [19] |
LIANG Y, YOO H D, LI Y F, et al. Interlayer-expanded molybdenum disulfide nanocomposites for electrochemical magnesium storage[J]. Nano Letters, 2015, 15(3): 2194-2202. DOI:10.1021/acs.nanolett.5b00388 |
| [20] |
LIU Y C, FAN L Z, JIAO L F. Graphene intercalated in graphene-like MoS2: a promising cathode for rechargeable Mg batteries[J]. Journal of Power Sources, 2017, 340: 104-110. DOI:10.1016/j.jpowsour.2016.11.060 |
| [21] |
XUE X L, CHEN R P, YAN C Z, et al. One-step synthesis of 2-ethylhexylamine pillared vanadium disulfide nanoflowers with ultralarge interlayer spacing for high-performance magnesium storage[J]. Advanced Energy Materials, 2019, 9(22): 1900145. DOI:10.1002/aenm.201900145 |
| [22] |
PEI C Y, YIN Y M, SUN R M, et al. Interchain-expanded vanadium tetrasulfide with fast kinetics for rechargeable magnesium batteries[J]. ACS Applied Materials & Interfaces, 2019, 11(35): 31954-31961. |
| [23] |
SHEN Y L, WANG Y J, MIAO Y C, et al. High-energy interlayer-expanded copper sulfide cathode material in non-corrosive electrolyte for rechargeable magnesium batteries[J]. Advanced Materials, 2019, 32(4): 1905524. |
| [24] |
YOO H D, LIANG Y L, DONG H, et al. Fast kinetics of magnesium monochloride cations in interlayer-expanded titanium disulfide for magnesium rechargeable batteries[J]. Nature Communications, 2017, 8(1): 339. DOI:10.1038/s41467-017-00431-9 |
| [25] |
PERERA S D, ARCHER R B, DAMIN C A, et al. Controlling interlayer interactions in vanadium pentoxide-poly(ethylene oxide) nanocomposites for enhanced magnesium-ion charge transport and storage[J]. Journal of Power Sources, 2017, 343: 580-591. DOI:10.1016/j.jpowsour.2017.01.052 |
| [26] |
WU D Z, ZENG J, HUA H M, et al. NaV6O15: a promising cathode material for insertion/extraction of Mg2+ with excellent cycling performance[J]. Nano Research, 2020, 13(2): 335-343. DOI:10.1007/s12274-019-2602-6 |
| [27] |
DENG X W, XU Y N, AN Q Y, et al. Manganese ion pre-intercalated hydrated vanadium oxide as a high-performance cathode for magnesium ion batteries[J]. Journal of Materials Chemistry A, 2019, 7(17): 10644-10650. DOI:10.1039/C8TA11236C |
| [28] |
XU Y N, DENG X W, LI Q D, et al. Vanadium oxide pillared by interlayer Mg2+ ions and water as ultralong-life cathodes for magnesium-ion batteries[J]. Chem, 2019, 5(5): 1194-1209. DOI:10.1016/j.chempr.2019.02.014 |
| [29] |
TANG H, XIONG F Y, JIANG Y L, et al. Alkali ions pre-intercalated layered vanadium oxide nanowires for stable magnesium ions storage[J]. Nano Energy, 2019, 58: 347-354. DOI:10.1016/j.nanoen.2019.01.053 |
| [30] |
RASHAD M, ZHANG H Z, ASIF M, et al. Low-cost room-temperature synthesis of NaV3O8·1.69H2O nanobelts for Mg batteries[J]. ACS Applied Materials & Interfaces, 2018, 10(5): 4757-4766. |
| [31] |
ZHANG R G, YU X Q, NAM K W, et al. α-MnO2 as a cathode material for rechargeable Mg batteries[J]. Electrochemistry Communications, 2012, 23: 110-113. DOI:10.1016/j.elecom.2012.07.021 |
| [32] |
WANG M Q, YAGI S. Layered birnessite MnO2 with enlarged interlayer spacing for fast Mg-ion storage[J]. Journal of Alloys and Compounds, 2020, 820: 153135. DOI:10.1016/j.jallcom.2019.153135 |
| [33] |
ER D Q, LI J W, NAGUIB M, et al. Ti3C2 MXene as a high capacity electrode material for metal (Li, Na, K, Ca) ion batteries[J]. ACS Applied Materials & Interfaces, 2014, 6(14): 11173-11179. |
| [34] |
XU M, LEI S L, QI J, et al. Opening magnesium storage capability of two-dimensional MXene by intercalation of cationic surfactant[J]. ACS Nano, 2018, 12(4): 3733-3740. DOI:10.1021/acsnano.8b00959 |
| [35] |
ZHOU L M, LIU Q, ZHANG Z H, et al. Interlayer-spacing-regulated VOPO4 nanosheets with fast kinetics for high-capacity and durable rechargeable magnesium batteries[J]. Advanced Materials, 2018, 30(32): 1801984. DOI:10.1002/adma.201801984 |
| [36] |
NOVÁK P, DESILVESTRO J. Electrochemical insertion of magnesium in metal oxides and sulfides from aprotic electrolytes[J]. Journal of the Electrochemical Society, 1993, 140(1): 140. DOI:10.1149/1.2056075 |
| [37] |
NOVÁK P, SCHEIFELE W, JOHO F, et al. Electrochemical insertion of magnesium into hydrated vanadium bronzes[J]. Journal of the Electrochemical Society, 1995, 142(8): 2544. DOI:10.1149/1.2050051 |
| [38] |
YU L, ZHANG X G. Electrochemical insertion of magnesium ions into V2O5 from aprotic electrolytes with varied water content[J]. Journal of Colloid and Interface Science, 2004, 278(1): 160-165. DOI:10.1016/j.jcis.2004.05.028 |
| [39] |
SAI GAUTAM G, CANEPA P, RICHARDS W D, et al. Role of structural H2O in intercalation electrodes: the case of Mg in nanocrystalline xerogel-V2O5[J]. Nano Letters, 2016, 16(4): 2426-2431. DOI:10.1021/acs.nanolett.5b05273 |
| [40] |
SA N, KINNIBRUGH T L, WANG H, et al. Structural evolution of reversible Mg insertion into a bilayer structure of V2O5·nH2O xerogel material[J]. Chemistry of Materials, 2016, 28(9): 2962-2969. DOI:10.1021/acs.chemmater.6b00026 |
| [41] |
JI X, CHEN J, WANG F, et al. Water-activated VOPO4 for magnesium ion batteries[J]. Nano Letters, 2018, 18(10): 6441-6448. DOI:10.1021/acs.nanolett.8b02854 |
| [42] |
NAM K W, KIM S, LEE S, et al. The high performance of crystal water containing manganese birnessite cathodes for magnesium batteries[J]. Nano Letters, 2015, 15(6): 4071-4079. DOI:10.1021/acs.nanolett.5b01109 |
| [43] |
SON S B, GAO T, HARVEY S P, et al. An artificial interphase enables reversible magnesium chemistry in carbonate electrolytes[J]. Nature Chemistry, 2018, 10(5): 532-539. DOI:10.1038/s41557-018-0019-6 |
| [44] |
LEVI M D, LANCRI E, LEVI E, et al. The effect of the anionic framework of Mo6X8 chevrel phase(X=S, Se) on the thermodynamics and the kinetics of the electrochemical insertion of Mg ions[J]. Solid State Ionics, 2005, 176(19/22): 1695-1699. |
| [45] |
AURBACH D, SURESH G S, LEVI E, et al. Progress in rechargeable magnesium battery technology[J]. Advanced Materials, 2007, 19(23): 4260-4267. DOI:10.1002/adma.200701495 |
| [46] |
MAO M L, JI X, HOU S, et al. Tuning anionic chemistry to improve kinetics of Mg intercalation[J]. Chemistry of Materials, 2019, 31(9): 3183-3191. DOI:10.1021/acs.chemmater.8b05218 |
| [47] |
WANG Z T, ZHU Y Q, QIAO C, et al. Anionic Se-substitution toward high-performance CuS1-xSex nanosheet cathode for rechargeable magnesium batteries[J]. Small, 2019, 15(42): 1902797. DOI:10.1002/smll.201902797 |
| [48] |
TANG H, PENG Z, WU L, et al. Vanadium-based cathode materials for rechargeable multivalent batteries: challenges and opportunities[J]. Electrochemical Energy Reviews, 2018, 1(2): 169-199. DOI:10.1007/s41918-018-0007-y |
| [49] |
ZENG J, YANG Y, LAI S B, et al. A promising high-voltage cathode material based on mesoporous Na3V2(PO4)3/C for rechargeable magnesium batteries[J]. Chemistry, 2017, 23(66): 16898-16905. DOI:10.1002/chem.201704303 |
| [50] |
ZENG J, WU D Z, WANG X, et al. Insights into the mg storage property and mechanism based on the honeycomb-like structured Na3V2(PO4)3/C/G in anhydrous electrolyte[J]. Chemical Engineering Journal, 2019, 372: 37-45. DOI:10.1016/j.cej.2019.04.128 |
| [51] |
ORIKASA Y, MASESE T, KOYAMA Y, et al. High energy density rechargeable magnesium battery using earth-abundant and non-toxic elements[J]. Scientific Reports, 2014, 4: 5622. |
| [52] |
KOKETSU T, MA J W, MORGAN B J, et al. Reversible magnesium and aluminium ions insertion in cation-deficient anatase TiO2[J]. Nature Materials, 2017, 16(11): 1142-1148. DOI:10.1038/nmat4976 |
| [53] |
RASHAD M, ASIF M, WANG Y X, et al. Recent advances in electrolytes and cathode materials for magnesium and hybrid-ion batteries[J]. Energy Storage Materials, 2020, 25: 342-375. DOI:10.1016/j.ensm.2019.10.004 |
| [54] |
XU Y N, CAO W J, YIN Y M, et al. Novel NaTi2(PO4)3 nanowire clusters as high performance cathodes for Mg-Na hybrid-ion batteries[J]. Nano Energy, 2019, 55: 526-533. DOI:10.1016/j.nanoen.2018.10.064 |
| [55] |
CHO J H, AYKOL M, KIM S, et al. Controlling the intercalation chemistry to design high-performance dual-salt hybrid rechargeable batteries[J]. Journal of the American Chemical Society, 2014, 136(46): 16116-16119. DOI:10.1021/ja508463z |
| [56] |
GAO T, HAN F D, ZHU Y J, et al. Hybrid Mg2+/Li+ battery with long cycle life and high rate capability[J]. Advanced Energy Materials, 2015, 5(5): 1401507. DOI:10.1002/aenm.201401507 |
| [57] |
WALTER M, KRAVCHYK K V, IBÁÑEZ M, et al. Efficient and inexpensive sodium-magnesium hybrid battery[J]. Chemistry of Materials, 2015, 27(21): 7452-7458. DOI:10.1021/acs.chemmater.5b03531 |
| [58] |
BIAN X F, GAO Y, FU Q, et al. A long cycle-life and high safety Na+/Mg2+ hybrid-ion battery built by using a TiS2 derived titanium sulfide cathode[J]. Journal of Materials Chemistry A, 2017, 5(2): 600-608. DOI:10.1039/C6TA08505A |
| [59] |
DONG H, LI Y F, LIANG Y L, et al. A magnesium-sodium hybrid battery with high operating voltage[J]. Chemical Communications, 2016, 52(53): 8263-8266. DOI:10.1039/C6CC03081E |
| [60] |
WANG Y R, WANG C X, YI X, et al. Hybrid Mg/Li-ion batteries enabled by Mg2+/Li+ co-intercalation in VS4 nanodendrites[J]. Energy Storage Materials, 2019, 23: 741-748. DOI:10.1016/j.ensm.2019.06.001 |
| [61] |
ZENG J, CAO Z L, YANG Y, et al. A long cycle-life Na-Mg hybrid battery with a chlorine-free electrolyte based on Mg(TFSI)2[J]. Electrochimica Acta, 2018, 284: 1-9. DOI:10.1016/j.electacta.2018.07.111 |
 2021, Vol. 49
2021, Vol. 49