文章信息
- 何小云, 葛笑, 宋留名, 杨婷婷, 李圆科, 苟进胜
- HE Xiao-yun, GE Xiao, SONG Liu-ming, YANG Ting-ting, LI Yuan-ke, GOU Jin-sheng
- 室温下MnOx/HZSM-5催化氧化甲醛的性能和机理分析
- Performance and mechanism analysis of MnOx/HZSM-5 catalytic oxidation of formaldehyde at room temperature
- 材料工程, 2021, 49(1): 144-152
- Journal of Materials Engineering, 2021, 49(1): 144-152.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2020.000461
-
文章历史
- 收稿日期: 2020-05-15
- 修订日期: 2020-11-04
甲醛污染会引发一系列人体健康问题和环境安全问题,其净化方法一直被人们所关注。常见甲醛净化方法有吸附法和催化氧化法,吸附法便于操作、成本低,但是吸附效率不高、易脱附、易产生二次污染,在应用中有许多限制。与吸附法相比,催化氧化法能够将甲醛氧化成无害物质,净化效果好、不会产生二次污染,是一种有效、有应用前景的甲醛净化方法。
分子筛具有高热稳定性、选择吸附性、较大的比表面积等特点,是良好的催化剂载体,其负载型催化剂能够有效分散活性组分、提高催化活性、降低成本,在实际应用中有许多优势。由于环境温度和室内温度的限制,能否在室温条件下有效催化氧化甲醛对实际应用至关重要,一般的催化剂需要高温来激活氧化反应,这会消耗大量能量且不适用室内甲醛的清除,因此室温催化剂得到越来越多的关注。在分子筛负载型催化剂中,室温催化活性最高的是分子筛负载贵金属催化剂,Chen等[1]利用浸渍法制备0.4%(质量分数,下同)Pt/ZSM-5催化氧化甲醛,30 ℃下该催化剂对甲醛转化率高达95%。Zhang等[2]利用富铝BEA分子筛作为催化剂载体负载1%铂金属室温下催化甲醛,研究表明这种催化剂能够在室温条件下将甲醛完全氧化,达到100%的转化率。Zhang等[3]利用BEA分子筛为载体负载0.2%Pt催化氧化甲醛,这种催化剂能够在室温条件下将甲醛完全氧化为二氧化碳和水。此类催化剂能够在室温条件下有效催化氧化甲醛,达到净化甲醛的目的,但是价格昂贵且贵金属资源缺乏,不适合大范围使用[4]。
过渡金属氧化物资源丰富、价格低廉,具有一定的催化活性,是贵金属催化剂的良好替代[5]。在过渡金属氧化中,锰基催化剂在氧化甲醛中表现出优越的催化活性,Zhang等[6]采用水热法制备了晶体结构不同的α-MnO2,β-MnO2,γ-MnO2,δ-MnO2催化剂,对其低温催化氧化甲醛进行研究,在众多的锰基催化剂中,δ-MnO2催化剂的低温催化活性最高,80 ℃下能够完全氧化甲醛。Tian等[7]合成了一种多孔氧化锰K-OMS-2纳米颗粒材料催化氧化甲醛,与传统的K-OMS-2纳米棒相比表现出更好的催化活性,100 ℃下64%的甲醛可被氧化为二氧化碳。Wang等[8]利用一步法制备纳米碳修饰的MnO2在室温下实现甲醛的完全氧化。虽然锰基催化剂具有较好的催化活性,但是会出现催化剂结晶性差、易团聚、易失活的现象,直接影响催化剂的催化稳定性和再生活性,在实际应用中有许多限制。
利用催化氧化法室温净化甲醛的研究中仍存在一些不足,因此本研究选用具有较大的比表面积的分子筛作为催化剂载体,有效分散活性组分,延长催化剂使用周期,使催化剂表现出更佳的催化活性;以价格低廉的锰氧化物作为活性组分,降低催化剂成本,便于实际生活中大范围使用。本研究目的在于研究出室温条件下能够高效催化氧化甲醛、再生稳定性良好、价格低廉、制备方法简单的催化剂,通过原位合成法制备分子筛负载活性氧化锰的MnOx/HZSM-5催化剂室温催化氧化甲醛,对比分析MnOx/HZSM-5对甲醛的清除效率和再生稳定性,阐明MnOx/HZSM-5对甲醛的催化机理。
1 实验材料与方法 1.1 催化剂的制备本实验以HZSM-5(南开大学催化厂)为载体、KMnO4(分析纯,北京现代东方精细化学品有限公司)为氧化锰的前驱体、CH3OH(分析纯,上海麦克林生化科技有限公司)作为还原剂,利用原位合成法制备MnOx/HZSM-5。催化剂的具体制备过程如下:将2 g高锰酸钾溶解于150 mL去离子水中,加入2 g的HZSM-5到高锰酸钾溶液中,之后向混合溶液中逐滴加入10 mL甲醇溶液,常温下低速搅拌12 h,样品经抽滤后在110 ℃干燥12 h,最后得到MnOx/HZSM-5催化剂。
1.2 催化剂的表征本实验采用ULTIMA Ⅳ型仪器进行XRD表征测试;采用HR Evolution型号的仪器进行Raman表征测试;采用ESCALAB 250Ⅺ型号仪器进行XPS表征测试;采用S4800型号仪器进行SEM表征测试;采用FEI TF30进行TEM表征测试;采用NICOLET IS10 J进行FTIR表征测试。
1.3 催化剂性能测试 1.3.1 动态性能测试室温下,在动态固定床装置中进行催化剂性能测试。将100 mg的样品填充到直径0.9 cm的聚四氟乙烯管中,通入干空气、湿空气和甲醛气体共同合成的混合空气,甲醛气体由合成空气鼓吹出甲醛溶液获得,湿空气由合成空气鼓吹水蒸气获得。甲醛初始浓度为0.15 mg/m3,相对湿度为60%,空气总流速为1 L/min。甲醛进出口浓度采用国标酚试剂(MBTH)分光光度法进行测试。
1.3.2 再生性能测试室温下,样品性能再生测试在动态固定床装置中进行,将100 mg样品于110 ℃下干燥1 h进行再生,以300 min为一个测试周期,共测试5次。
1.3.3 静态性能测试室温下,将200 mg的样品放在3.5 L的玻璃反应舱中并用玻璃盖盖住样品,向反应舱内注射10 μL的甲醛溶液,待甲醛挥发至200×10-6时,迅速打开样品上的玻璃盖使MnOx/HZSM-5充分暴露。利用PN-2000传感器实时监测甲醛浓度变化,气相色谱仪(GC-2014)实时监测甲醛氧化的二氧化碳量。
催化剂对甲醛催化性能优劣由甲醛清除率X和甲醛转化率Y评价。

|
(1) |
式中:[HCHO]in为甲醛初始浓度,1×10-6;[HCHO]out为甲醛最终浓度,1×10-6。
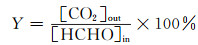
|
(2) |
式中:[CO2]out为产生的二氧化碳浓度,1×10-6。
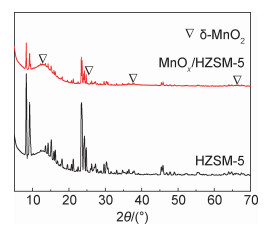
2 结果与分析 2.1 形貌与结构分析对MnOx/HZSM-5和HZSM-5进行XRD图谱分析,研究样品的物相结构。如图 1所示,MnOx/HZSM-5显现出典型的MFI结构特征衍射峰,这表明负载MnOx几乎不会改变HZSM-5分子筛的骨架结构。与HZSM-5相比,MnOx/HZSM-5的峰强度有所降低,结晶度较差。在12.5°,25.3°,37.2°和65.8°处的2θ衍射峰对应δ-MnO2的(001),(002),(100)和(110)的晶面[9],但是在MnOx/HZSM-5的图谱上几乎看不到δ-MnO2特征衍射峰,这可能是因为MnOx在HZSM-5上具有良好的分散性。从XRD图谱信息可知,MnOx在HZSM-5具有完整的骨架结构和良好的机械强度,MnOx的分散性良好,但是催化剂结晶度较低。
|
图 1 MnOx/HZSM-5和HZSM-5的XRD图谱 Fig. 1 XRD patterns of MnOx/HZSM-5 and HZSM-5 |
为进一步了解催化剂的结构特性,对HZSM-5和MnOx/HZSM-5进行拉曼图谱分析。如图 2所示,在494.9,576.5 cm-1和636.4 cm-1处出现由δ-MnO2中Mn—O拉伸振动得到的特征拉曼散射峰,636.4 cm-1处的拉曼位移由[MnO6]基团沿层间方向上Mn—O的对称拉伸振动所引起[10],表明δ-MnO2的层间结构中存在大量的阳离子,如Na+,K+等,这些层间阳离子有助于维持δ-MnO2结构稳定;576.5 cm-1处的谱带通常由[MnO6]基团片基面上的Mn—O拉伸振动所引起,根据以上图谱信息判断MnOx/HZSM-5催化剂所负载的氧化锰极大可能是δ-MnO2。

|
图 2 MnOx/HZSM-5和HZSM-5的Raman图谱 Fig. 2 Raman spectra of MnOx/HZSM-5 and HZSM-5 |
利用SEM表征HZSM-5负载氧化锰前后微观形貌变化,如图 3(a)所示,HZSM-5表面光滑,晶型较为完整,仅个别晶粒表面有少许破损,晶粒大小约为0.79 μm×1.1 μm×0.5 μm[11]。HZSM-5结构呈现六棱柱形状,这是MFI晶体的典型形态。如图 3(b)所示,MnOx/HZSM-5催化剂的表面上形成了一层较为均匀且致密的纳米氧化锰,纳米氧化锰呈现出纳米圆球的形貌,圆球的形成归因于单个片状纳米氧化锰的团聚。本应呈片状结构的纳米氧化锰在形成过程中会发生团聚,随着各个纳米片团聚过程的进行,片状纳米氧化锰变得更加致密并聚集在一起,最终形成花簇状圆球并负载在分子筛表面[9],Li等[12]和Zhou等[13]也报道了片状纳米材料团聚形成花簇状圆球的类似现象。

|
图 3 HZSM-5(a)和MnOx/HZSM-5(b)的SEM图 Fig. 3 SEM images of HZSM-5 (a) and MnOx/HZSM-5 (b) |
对MnOx/HZSM-5催化剂进行TEM表征测试,如图 4所示,催化剂表面含有大量具有均匀的层状纳米片结构的MnOx,这与文献报道的δ-MnO2的结构是一致的[14],图像显示MnOx具有0.24 nm的条纹间距,与δ-MnO2的(111)面的晶面间距保持一致[15]。催化剂TEM表征测试与Raman表征相吻合,进一步证明负载在HZSM-5分子筛上的氧化锰可能是δ-MnO2。

|
图 4 MnOx/HZSM-5的TEM图 Fig. 4 TEM images of MnOx/HZSM-5 |
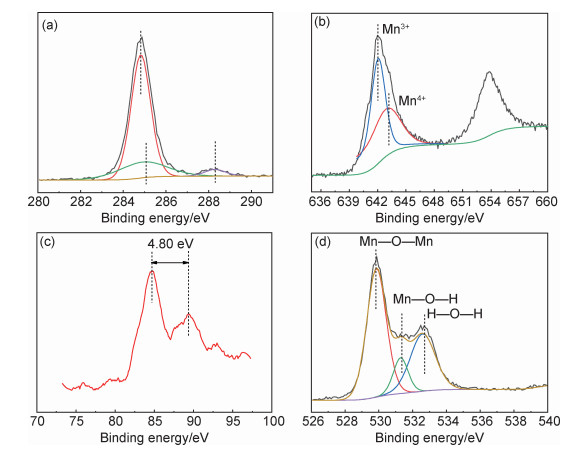
利用XPS测量MnOx/HZSM-5中催化剂的表面化学状态,对C1s,Mn2p,Mn3s,O1s进行分析。图 5(a)显示C1s的XPS结合能谱图,C1s的特征峰在284.84 eV处由3个峰组成:284.78~284.92 eV处的石墨基和芳香基团、285.15~285.38 eV处的酚羟基或醚基、288.23~288.35 eV处的羰基基团[16-17]。催化剂288.23~288.35 eV处的羧基组分较为富集,有研究表明,羧基的浓度与催化活性密切相关,增强催化剂表面羧基组分密集程度可以有效提高甲醛氧化速率和催化剂的存储能力[18-19]。图 5(b)显示Mn2p的结合能谱图,Mn2p谱图在653.84 eV和642.05 eV处出现的两个特征峰分别与Mn2p1/2和Mn2p3/2的自旋轨道峰相关,二者之间结合能差值ΔE2p为11.79 eV,使用Thermo Avantage软件可以将Mn2p3/2对应的特征峰分峰成643.32 eV和642.04 eV处的两个峰,这两个峰分别对应不同价态的锰离子Mn4+和Mn3+[20]。图 5(c)显示了Mn3s的谱图,Mn3s的结合能差值ΔE3s为4.80 eV,根据以往相关研究的经验公式[21]:可知锰氧化物中锰的平均价态为8.956-1.126ΔE3s,得出锰的平均价态为3.551。说明锰氧化物中Mn4+的氧化物比Mn3+的氧化物要多,锰氧化物多以MnO2的形式存在,这与上述分析结果一致。将氧元素的O1s谱图利用Thermo Avantage分峰后如图 5(d)所示,529.81 eV处对应Mn—O—Mn的晶格氧(Olat)的特征峰、531.31 eV处对应Mn—O—H的表面吸附氧(Oads)的特征峰、532.62 eV处对应H—O—H的表面吸附氧(Oads)特征峰[22]。图 5(d)中氧基团的面积相对较大,表明催化剂上的表面氧基团的数量非常丰富,这有利于促进羟基(—OH)、羰基(—COOH)和表面活性化学吸附氧(O2-,O-等)的形成,进而推动整个氧化过程的进行。有研究表明[23],氧空位和晶格缺陷是影响催化活性的至关重要的因素,通常,当Mn3+出现在MnOx中时,将根据以下过程产生氧空位,以保持静电平衡[1]:
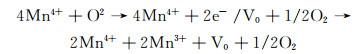
|
(3) |
|
图 5 MnOx/HZSM-5催化剂的XPS图谱 (a)C1s;(b)Mn2p;(c)Mn3s;(d)O1s Fig. 5 XPS spectra of MnOx/HZSM-5 catalyst (a)C1s;(b)Mn2p;(c)Mn3s;(d)O1s |
V0代表氧空位,MnOx/HZSM-5催化剂中较为丰富的吸附氧和氧空位,这有利于提高催化活性。
2.3 催化剂的性能测试 2.3.1 催化剂动态性能测试在动态条件下对HZSM-5和MnOx/HZSM-5两种样品进行活性测试,测试结果如图 6所示,HZSM-5属于高硅分子筛,与低硅分子筛相比具有较好的疏水性,因此在甲醛和水分子竞争吸附前期,HZSM-5表现出较好的甲醛的吸附能力,室温条件下360 min内HZSM-5对甲醛的清除率都保持在80%以上,但是随着吸附的进行,甲醛和水分子的竞争吸附越来越激烈,导致在吸附660 min后HZSM-5对甲醛的清除率逐渐下降到58%,并呈现出逐渐下降的趋势。与HZSM-5相比,MnOx/HZSM-5催化剂则表现出优异的甲醛净化效果,反应660 min后,甲醛清除率保持在94%,随着反应的进行,1020 min后MnOx/HZSM-5对甲醛的清除率仍然保持在90%左右,这归功于MnOx良好的催化活性和HZSM-5良好的吸附存储能力的协同作用。
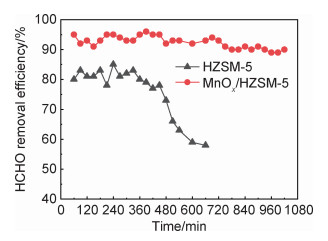
|
图 6 室温下HZSM-5和MnOx/HZSM-5的清除率随时间变化曲线 Fig. 6 Clearance of HZSM-5 and MnOx/HZSM-5 over time at room temperature |
在实际应用中,催化剂的再生活性起着至关重要的作用,因此对MnOx/HZSM-5和HZSM-5分别进行再生测试,样品经测试后在110 ℃下干燥1 h进行再生,共测试5次。如图 7所示,首次测试时,HZSM-5和MnOx/HZSM-5对甲醛的清除率分别保持在93%,80%左右,HZSM-5在经第3次测试后活性明显下降,5次测试后,甲醛清除率逐渐下降至59%并有逐渐下降的趋势。与HZSM-5相比,MnOx/HZSM-5表现出优良的再生性,5次再生测试后MnOx/HZSM-5的甲醛清除率保持在91%,说明MnOx/HZSM-5具有良好的再生性。

|
图 7 室温下MnOx/HZSM-5 (a)和HZSM-5 (b)再生性测试 Fig. 7 Regenerative test of MnOx/HZSM-5 (a) and HZSM-5 (b) at room temperature |
MnOx/HZSM-5在动态活性测试和再生测试中都表现出很高的甲醛清除率,与HZSM-5相比,在动态活性测试660 min时MnOx/HZSM-5对甲醛的清除率提高62%,再生测试5次后MnOx/HZSM-5对甲醛的清除率提高52%,说明MnOx/HZSM-5催化剂能够通过催化氧化法有效净化甲醛,是一种稳定、高效、可再生的甲醛催化材料。
2.3.2 催化剂静态性能测试为进一步确定在高甲醛浓度下MnOx/HZSM-5对甲醛的清除率和转化率,室温条件下对HZSM-5和MnOx/HZSM-5进行静态测试,HZSM-5和MnOx/HZSM-5的甲醛清除率和甲醛转化率变化曲线如图 8所示,HZSM-5对甲醛有一定的吸附作用,吸附2 h后,玻璃反应舱内甲醛浓度为54×10-6,对应的甲醛清除率为73%,之后随着时间变化甲醛浓度基本保持不变,7.5 h后玻璃反应舱内甲醛浓度为50×10-6,甲醛清除率为75%。整个HZSM-5吸附过程中通过GC-FID并未检测到二氧化碳的产生,说明HZSM-5对甲醛仅仅是吸附作用,室温下并不能将甲醛氧化。相同条件下,MnOx/HZSM-5表现出更好的甲醛清除率和甲醛转化率。反应2 h后,玻璃反应舱内甲醛浓度迅速降至18×10-6,甲醛的清除率高达91%,通过GC-FID检测到大量二氧化碳产生同时并未检测到一氧化碳的产生,产生的二氧化碳浓度为75×10-6,相应的甲醛转化率为37.5%。随着催化反应的继续进行,产生的二氧化碳的量逐渐增多,MnOx/HZSM-5对应的甲醛转化率变化曲线趋于平稳,最终在7.5 h时甲醛的清除率达到97%,甲醛的转化率达到92%。因此,可以证明MnOx/HZSM-5催化剂在室温下能够有效净化甲醛,甲醛清除率和转化率接近100%,这归功于HZSM-5良好的吸附储存能力和MnOx优良的氧化能力的协同作用,催化剂的晶体结构、MnOx的良好的分散性、丰富的表面氧基团、氧空位和丰富的Mn3+对甲醛的氧化起重要作用,这都有利于催化氧化甲醛。

|
图 8 室温下MnOx/HZSM-5和HZSM-5的甲醛清除率和甲醛转化率随时间变化曲线 Fig. 8 Time curves of formaldehyde removal rate and formaldehyde conversion rate of MnOx/HZSM-5 and HZSM-5 at room temperature |
甲醛氧化的研究表明甲醛被氧化的最终产物是二氧化碳[24],本实验验证了这一结论。但是由图 8中可以看出,MnOx/HZSM-5对甲醛的清除率和甲醛转化率并不同步,即一定量的甲醛被氧化的同时并没有实时产生同等量的二氧化碳,这可能是因为甲醛氧化中有中间产物的产生,短时间内MnOx/HZSM-5无法将甲醛完全转化为二氧化碳。
2.4 催化剂氧化甲醛的机理分析通过样品的静态测试结果得知MnOx/HZSM-5甲醛氧化的最终产物为二氧化碳,为了研究甲醛氧化中间产物,对静态测试反应前、反应后和再生后不同状态的MnOx/HZSM-5催化剂进行红外光谱表征。如图 9所示,801.49 cm-1处由MFI型分子筛结构中孤立的Si—OH基团的变形所致[25],1085.07 cm-1处和554.47 cm-1处的强谱带分别由分子筛中O—Si—O,O—Al—O的不对称拉伸和弯曲振动引起[26]。1636.12 cm-1和3439.67 cm-1处的谱带被认为是MnOx/HZSM-5催化剂中羟基组分,观察到反应前、反应后和再生后的MnOx/HZSM-5催化剂上羧基成分的浓度发生了变化,反应后羧基成分被还原,富集程度有所减少,这可能是因为中间产物的产生和氧化需要消耗羧基成分,羧基组分在一定程度上影响催化效率。
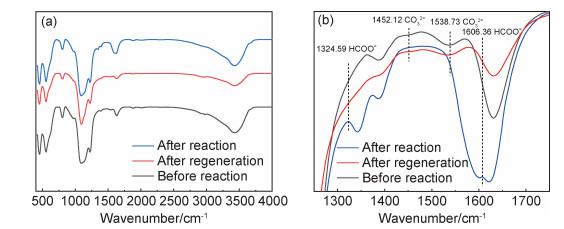
|
图 9 MnOx/HZSM-5的FTIR谱图 (a)全谱图;(b)部分放大的谱图 Fig. 9 FTIR spectra of MnOx/HZSM-5 (a)full spectra; (b)partially enlarged spectra |
Wang等[8]利用层状氧化锰氧化甲醛的研究表明羧基组分会明显促进甲酸盐类物质的形成,补充羧基组分能够提高甲醛氧化速率。Zhang等[27]利用2%Na-1%Pt/TiO2催化氧化甲醛,研究发现羧基组分会和甲酸盐类物质直接反应生成二氧化碳。因此,催化剂上的羧基组分密集程度影响氧化甲醛的反应进程,MnOx/HZSM-5催化剂上羧基组分较为密集,这可能有利于促进甲醛的催化氧化。与反应前和再生后的MnOx/HZSM-5相比,反应后的MnOx/HZSM-5催化剂在1324.59 cm-1处和1606.36 cm-1处出现了明显的吸收峰,对应甲酸盐类物质的吸收峰,1452.12 cm-1处和1538.73 cm-1处的对应碳酸盐类物质的吸收峰,但是反应后的MnOx/HZSM-5酸盐类物质吸收峰并不明显[6]。因此,以MnOx/HZSM-5为催化剂,将甲醛氧化为二氧化碳的过程中,确实存在中间产物甲酸盐类物质和碳酸盐类物质的产生,这是导致甲醛清除率和甲醛转化率不同步的主要原因。
根据表征实验和活性实验的数据分析,对MnOx/HZSM-5催化氧化甲醛的机理进行总结,机理示意图如图 10所示。
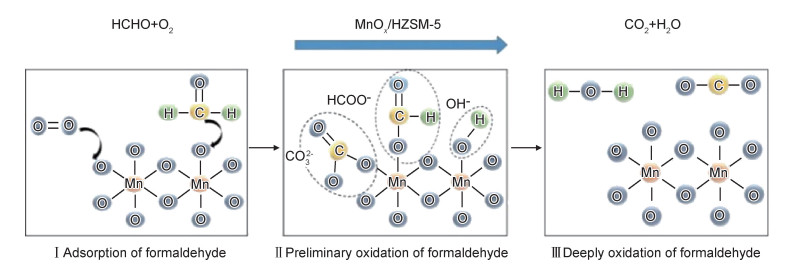
|
图 10 MnOx/HZSM-5催化氧化甲醛的机理示意图 Fig. 10 Schematic diagram of MnOx/HZSM-5 catalytic oxidation of formaldehyde |
甲醛氧化主要分为三个阶段,第一阶段,甲醛的吸附和储存。甲醛被HZSM-5分子筛吸附在活性成分MnOx表面,氧气在催化剂表面发生解离形成活化的氧基团;第二阶段,甲醛的初步氧化。吸附的甲醛室温下被活化氧基团初步氧化为甲酸盐或碳酸盐这类中间产物;第三阶段,甲醛的深度氧化。中间产物被深度氧化成二氧化碳和水。虽然中间产物的大量积累可能会导致MnOx/HZSM-5催化剂失活,但是MnOx/HZSM-5催化剂在110 ℃的空气中加热再生1 h后得到恢复,再生后的催化剂仍保持良好的结构特性和稳定性,在活性测试中表现出良好的催化活性。
动态活性测试、静态活性测试和再生测试中,MnOx/HZSM-5催化剂表现出良好的甲醛储存能力、催化活性和稳定性,可以在有效时间内净化甲醛。MnOx/HZSM-5催化剂合成方法简单、成本低、储存能力强、稳定性高,催化性能优良,在甲醛净化中具有广阔的应用前景。
3 结论(1) 本研究制备的MnOx/HZSM-5催化剂具有价格低廉、制备工艺简单、活性组分分散均匀、催化活性高、再生性强的特点,催化剂中富含丰富的羧基组分、氧空位,有利于催化氧化甲醛,能够在室温条件下有效净化甲醛。
(2) MnOx/HZSM-5催化剂在动态活性测试、再生活性测试和静态活性测试中都表现出良好的催化活性和再生稳定性。动态测试1020 min后MnOx/HZSM-5对甲醛的清除率仍然保持在90%,再生5次后,MnOx/HZSM-5对甲醛清除率仍然保持在91%,静态测试中甲醛清除率达到97%,甲醛转化率达到92%。这归功于具有良好催化活性的MnOx和良好吸附储存能力的HZSM-5二者之间的协同作用。
(3) 分析得出MnOx/HZSM-5对甲醛的催化机理,发现甲醛氧化过程分为三个步骤,第一步为甲醛的吸附和储存,HZSM-5分子筛将甲醛吸附在MnOx表面,同时氧气进行解离形成活化的氧组分;第二步为甲醛初步氧化,甲醛被活化氧组分氧化成中间产物,甲酸盐类物质或碳酸盐类物质;第三步甲醛深度氧化,中间产物被深度氧化为二氧化碳和水。
| [1] |
CHEN H, RUI Z, WANG X, et al. Multifunctional Pt/ZSM-5 catalyst for complete oxidation of gaseous formaldehyde at ambient temperature[J]. Catalysis Today, 2015, 258: 56-63. DOI:10.1016/j.cattod.2015.03.043 |
| [2] |
ZHANG L, CHEN L, LI Y, et al. Complete oxidation of formaldehyde at room temperature over an Al-rich Beta zeolite supported platinum catalyst[J]. Applied Catalysis B Environmental, 2017, 219: 200-208. DOI:10.1016/j.apcatb.2017.07.015 |
| [3] |
ZHANG L, JIANG Y, CHEN B, et al. Exceptional activity for formaldehyde combustion using siliceous Beta zeolite as a catalyst support[J]. Catalysis Today, 2020, 339: 174-180. DOI:10.1016/j.cattod.2019.01.016 |
| [4] |
高明明, 赵欢娟, 牟博, 等. 负载型贵金属低温催化氧化甲醛催化剂的研究[J]. 化学工程, 2019, 47(2): 18-24. GAO M M, ZHAO H J, MU B, et al. Study of noble metal catalysts for the oxidation of formaldehyde at low temperature[J]. Chemical Engineering(China), 2019, 47(2): 18-24. |
| [5] |
赵艳磊, 田华, 贺军辉, 等. 介孔氧化锰对甲醛的低温催化氧化[J]. 应用化工, 2017, 46(5): 814-819. ZHAO Y L, TIAN H, HE J H, et al. Low-temperature catalytic oxidation of formaldehyde over mesoporous manganese[J]. Applied Chemical Industry, 2017, 46(5): 814-819. DOI:10.3969/j.issn.1671-3206.2017.05.002 |
| [6] |
ZHANG J, LI Y, WANG L, et al. Catalytic oxidation of formaldehyde over manganese oxides with different crystal structures[J]. Catalysis Science & Technology, 2015, 5(4): 2305-2313. |
| [7] |
TIAN H, HE J, ZHANG X, et al. Facile synthesis of porous manganese oxide K-OMS-2 materials and their catalytic activity for formaldehyde oxidation[J]. Microporous and Mesoporous Materials, 2011, 138(1/3): 118-122. |
| [8] |
WANG J, ZHANG P, LI J, et al. Room-temperature oxidation of formaldehyde by layered manganese oxide:effect of water[J]. Environmental Science & Technology, 2015, 49(20): 12372-12379. |
| [9] |
LI J, ZHANG P, WANG J, et al. Birnessite-type manganese oxide on granular activated carbon for formaldehyde removal at room temperature[J]. Journal of Physical Chemistry C, 2016, 120(42): 24121-24129. DOI:10.1021/acs.jpcc.6b07217 |
| [10] |
JULIEN C, MASSOT M, BADDOUR-HADJEAN R, et al. Raman spectra of birnessite manganese dioxides[J]. Solid State Ionics, 2003, 159(3/4): 345-356. |
| [11] |
汪青松, 李工, 黄敏建. 含杂原子硼ZSM-5分子筛的合成及对甲醇脱氢制甲醛的催化性能[J]. 工业催化, 2013, 21(10): 57-62. WANG Q S, LI G, HUANG M J. Synthesis of boron-containing ZSM-5 molecular sieves and their catalytic performance in methanol dehydrogenation to formaldehyde[J]. Industrial Catalysis, 2013, 21(10): 57-62. DOI:10.3969/j.issn.1008-1143.2013.10.013 |
| [12] |
LI Y, WANG J, ZHANG Y, et al. Facile controlled synthesis and growth mechanisms of flower-like and tubular MnO2nanostructures by microwave-assisted hydrothermal method[J]. Journal of Colloid And Interface Science, 2012, 369(1): 123-128. DOI:10.1016/j.jcis.2011.12.013 |
| [13] |
ZHOU J, YU L, SUN M, et al. Novel synthesis of birnessite-type MnO2 nanostructure for water treatment and electrochemical capacitor[J]. Industrial & Engineering Chemistry Research, 2013, 52(28): 9586-9593. |
| [14] |
ZHOU L, ZHANG J, HE J, et al. Control over the morphology and structure of manganese oxide by tuning reaction conditions and catalytic performance for formaldehyde oxidation[J]. Materials Research Bulletin, 2011, 46(10): 1714-1722. DOI:10.1016/j.materresbull.2011.05.039 |
| [15] |
LIU S, ZHU Y G, XIE J, et al. Direct growth of flower-like δ-MnO2 on three-dimensional graphene for high-performance rechargeable Li-O2 batteries[J]. Advanced Energy Materials, 2014, 4(9): 1301960. DOI:10.1002/aenm.201301960 |
| [16] |
ZHU J, DENG B, YANG J, et al. Modifying activated carbon with hybrid ligands for enhancing aqueous mercury removal[J]. Carbon, 2009, 47(8): 2014-2025. DOI:10.1016/j.carbon.2009.03.047 |
| [17] |
ZHANG G, SUN S, YANG D, et al. The surface analytical characterization of carbon fibers functionalized by H2SO4/HNO3 treatment[J]. Carbon, 2008, 46(2): 196-205. DOI:10.1016/j.carbon.2007.11.002 |
| [18] |
DING J, CHEN J, RUI Z, et al. Synchronous pore structure and surface hydroxyl groups amelioration as an efficient route for promoting HCHO oxidation over Pt/ZSM-5[J]. Catalysis Today, 2018, 316: 107-113. DOI:10.1016/j.cattod.2018.01.031 |
| [19] |
CHEN H, TANG M, RUI Z, et al. ZnO modified TiO2 nanotube array supported Pt catalyst for HCHO removal under mild conditions[J]. 2016, 264(18): 23-30.
|
| [20] |
RONG S, ZHANG P, WANG J, et al. Ultrathin manganese dioxide nanosheets for formaldehyde removal and regeneration performance[J]. Chemical Engineering Journal, 2016, 306: 1172-1179. DOI:10.1016/j.cej.2016.08.059 |
| [21] |
ZHANG L, TU J, LYU L, et al. Enhanced catalytic degradation of ciprofloxacin over Ce-doped OMS-2 microspheres[J]. Applied Catalysis B, 2016, 181: 561-569. DOI:10.1016/j.apcatb.2015.08.029 |
| [22] |
FANG R, HUANG H, JIAN J, et al. Efficient MnOx supported on coconut shell activated carbon for catalytic oxidation of indoor formaldehyde at room temperature[J]. Chemical Engineering Journal, 2017, 334: 2050-2057. |
| [23] |
BAHRAMIAN B, ARDEJANI F D, MIRKHANI V, et al. Diatomite-supported manganese Schiff base:an efficient catalyst for oxidation of hydrocarbons[J]. Applied Catalysis A, 2008, 345(1): 97-103. DOI:10.1016/j.apcata.2008.04.028 |
| [24] |
崔维怡, 张宏庆, 茹静, 等. MnOx催化剂上甲醛催化氧化性能研究[J]. 科学技术创新, 2016, 32: 15. CUI W Y, ZHANG H Q, RU J, et al. Study on the catalytic oxidation performance of formaldehyde on MnOx catalyst[J]. Scientific and Technological Innovation, 2016, 32: 15. |
| [25] |
ZHDANOV S P, KOSHELEVA L S, TITOVA T I. IR study of hydroxylated silica[J]. Langmuir, 1987, 3(6): 960-967. DOI:10.1021/la00078a014 |
| [26] |
EDNEY C V, CONDRATE R A, CRANDALL W B, et al. Infrared and Raman spectra of Y2O3-SiO2glasses prepared by sol-gel processes[J]. Journal of Materials Science Letters, 1987, 6(3): 308-312. DOI:10.1007/BF01729336 |
| [27] |
ZHANG C, LIU F, ZHAI Y, et al. Alkali-metal-promoted Pt/TiO2 opens a more efficient pathway to formaldehyde oxidation at ambient temperatures[J]. Angewandte Chemie International Edition, 2012, 51(38): 9628-9632. DOI:10.1002/anie.201202034 |
 2021, Vol. 49
2021, Vol. 49


