文章信息
- 吴浩, 邱锦, 陈卫星, 杨晶晶, 马爱洁, 蔡力帆
- WU Hao, QIU Jin, CHEN Wei-xing, YANG Jing-jing, MA Ai-jie, CAI Li-fan
- 水铝英石/PEO/LiClO4复合固态聚合物电解质中组分相互作用对PEO结晶的影响
- Effect of interaction in allophane/PEO/LiClO4 composite solid polymer electrolyte on crystallization of PEO
- 材料工程, 2021, 49(1): 35-43
- Journal of Materials Engineering, 2021, 49(1): 35-43.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2020.000174
-
文章历史
- 收稿日期: 2020-03-03
- 修订日期: 2020-04-22
2. 陕西省光电功能材料与器件重点实验室, 西安 710021
2. Shaanxi Key Laboratory of Photoelectric Functional Materials and Devices, Xi'an 710021, China
随着化石能源的日益枯竭及其带来的环境污染问题的日益凸显,绿色能源技术引起了研究人员的广泛关注。锂离子电池(LIBs)因其质量轻、能量密度高、输出电压高、寿命长、对环境无污染等优点被广泛应用于手机、电脑等便携式电子产品中,被认为是绿色高能化学电源[1]。然而,传统的LIBs使用的有机液体电解质易燃、易挥发,有一定的毒性,且当电池出现破损后会迅速造成热失控,继而引发火灾甚至爆炸等事故[2]。与此类电解质相比,固态聚合物电解质(solid polymer electrolytes, SPEs)具有无漏液、热稳定性高、密封性好、易加工等优点,具有极高的安全性,成为固态电池领域的研究热点[3]。
在已报道的SPEs中,聚环氧乙烷(PEO)因其良好的链柔顺性、低玻璃化转变温度(Tg≈-60 ℃)、高介电常数(ε≈5)以及对锂盐良好的溶解性而成为固态电池工业化前景最好的聚合物[4-6]。根据Armand的研究,Li+主要通过与处于非晶区的PEO分子链上的—CH2CH2O—(EO)单元发生络合与解络合作用来实现离子传输[7]。然而,PEO在室温下的结晶度较高,使得Li+迁移能力受限(0.2~0.3),离子电导率较低(10-8~10-6 S·cm-1)。因此,复合体系中PEO的结晶形式及结晶程度严重影响SPEs的综合性能。
目前,研究人员通常采用降低PEO的结晶度来提高其电化学性能;为了同时保证聚合物电解质具有较好的力学性能,聚合物-无机粒子复合的方法被广泛关注[3]。Steele等在1982年首次向PEO-LiClO4体系中加入了体积分数为10%的α-Al2O3,降低了PEO分子的结晶,为Li+的传输提供了新的通道,也使复合体系的力学性能得到了明显的改善[8]。此后,大量不同的无机填料,如SiO2[9]、ZnO[10]、g-C3N4纳米片[11-12]、h-BN纳米片[13]以及Mg2B2O5纳米线[14]等被广泛用于固态电解质的研究中。在这种复合体系中,无机粒子表面的基团、阴/阳离子与PEO分子链之间存在的弱相互作用会发生新的络合,这种络合有助于降低PEO的结晶度,促进Li+沿PEO分子链的传输,同时也可以提高体系的力学稳定性[15-16]。但是,对于复合体系中组分之间的相互作用对复合固态聚合物电解质性能的影响还未有统一的认识。
本工作以Na2SiO3和AlCl3·6H2O为原料,采用溶胶-凝胶法制备出钟乳石块状结构水铝英石(allophane,记为AL),以其作为PEO基固态电解质的无机填料,研究AL与LiClO4的相互作用以及二者的含量对PEO结晶性能及其结晶形貌的影响,为铝硅酸盐矿物作为聚合物电解质填料提供一定的实验研究基础。
1 实验材料与方法 1.1 原材料和AL的制备硅酸钠(Na2SiO3)、氢氧化钠(NaOH)、六水氯化铝(AlCl3·6H2O)、氨水(NH3·H2O)和无水高氯酸锂(LiClO4)均由阿拉丁(中国)提供,PEO(Mw=6×105)购于Alfa Aesar(美国)化学有限公司,盐酸(HCl)购于广州化学试剂厂。所有试剂均为分析纯。
AL的制备方法以文献[17]报道的方法为基础。在高速搅拌下,将100 mL AlCl3水溶液(0.15 mol/L)缓慢地滴入到等量的Na2SiO3水溶液(0.1 mol/L)中;反应1 h后,将1 mol/L的NaOH水溶液滴入到所得的均相溶液中,直至体系pH为8,离心分离,得到白色溶胶;将获得的溶胶重新分散到200 mL去离子水中,用1 mol/L的盐酸来调节体系酸碱度,至pH为4,继续搅拌2 h;用10%(质量分数,下同)的NH3·H2O进一步调节体系的酸碱度,将pH值调节至8进行絮凝。絮凝产物经离心分离、冷冻干燥后得到白色固体粉末,即为AL产物。
1.2 PEO-LiClO4-AL(PLAL)复合固态聚合物电解质膜的制备复合固态聚合物电解质的制备流程如图 1所示。首先,以PEO质量为基础,控制AL对PEO的质量分数分别为0%,2%,5%和8%;然后,将AL粉末在超纯水中超声分散,按照EO与Li+的摩尔比为10:1,15:1和20:1分别向上述溶液中加入确定量的PEO和LiClO4,磁力搅拌形成均匀的混合液。最后将溶液铸入自制的PTFE模具中,在40 ℃的烘箱中低温烘干成型后,进一步利用真空干燥箱40 ℃持续烘干至完全干燥,待完全干燥后转移至手套箱备用。
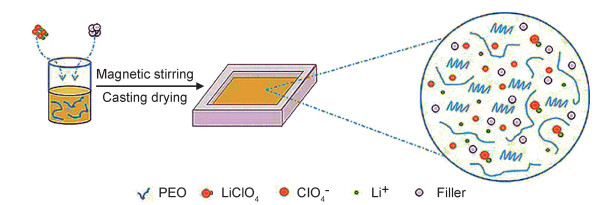
|
图 1 PEO-LiClO4-AL复合固态聚合物电解质膜的制备流程图及薄膜微结构的示意图 Fig. 1 Preparation flow chart of electrolyte film and schematic diagram of the microstructure of thin film in PEO-LiClO4-AL composite solid polymer electrolyte |
采用Vertex70型傅里叶变换红外光谱仪(FTIR)来分析AL的组成,分辨率为2 cm-1,扫描次数为32次;采用该仪器附带的ATRTM附件分析电解质薄膜,分辨率为2 cm-1,扫描次数为128次。采用XRD-6000型X射线衍射仪(XRD)对材料进行物相分析,光源为CuKα射线(λ=0.15406 nm),扫描范围为5°~70°。
根据Bragg方程2dsinθ=nλ(其中,d为晶面间距,θ为入射X射线与相应晶面的夹角,λ为波长,n为反射级数)计算晶面间距d;采用DSC823e型差示扫描量热仪(DSC)进行热分析,初始温度为30 ℃,终止温度为120 ℃,在氮气气氛下以10 ℃/min的升温速率进行测试。根据公式Xc=(ΔHm/ΔHm0)×100%(其中,Xc为结晶度,ΔHm为熔融焓,ΔHm0为平衡熔融焓)计算结晶度Xc;采用C-5050ZOOM型光学显微镜(OM)对电解质膜的形貌进行观察;采用SU-8010型场发射扫描电子显微镜(SEM)观察所制备的AL的表面形貌;采用JEM-2010型透射电子显微镜(TEM)观察所制备的AL的形貌和粒径大小。
2 结果与讨论 2.1 AL的表征对所制备的AL进行结晶结构及组成分析,结果如图 2所示。图 2(a)为AL的XRD图谱,在2θ=26.7°,40.6°位置出现衍射峰,表明其内部具有周期性的有序结构。经Bragg方程计算可得,其对应的晶面间距分别为0.33 nm与0.225 nm,可归属于AL中Al-OH-Al晶胞的特征衍射峰[17]。AL的FTIR图谱如图 2(b)所示,可以明显看出样品在971,686,552 cm-1以及437 cm-1处有特征吸收峰,分别对应于Si—O,O—Al—O,Si—O—Al以及Al—O的伸缩振动,这一结果表明成功制备出AL。
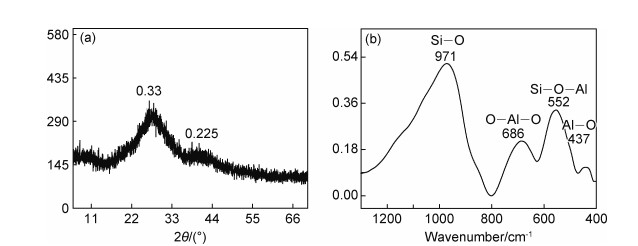
|
图 2 AL的XRD(a)和FTIR图谱(b) Fig. 2 XRD pattern(a) and the FTIR spectrum(b) of AL |
对所制备的AL进行形貌及元素分析,结果如图 3所示。从图 3(a),(b)可以看出,AL表面粗糙,由小颗粒聚集而堆叠在一起。图 3(c)为AL的TEM图,AL颗粒呈现钟乳石块状结构,最大尺寸约为1.3 μm。图 3(d)为所制备AL的EDS图。分析结果显示:AL中除含有O元素外,还含有C,Al和Si元素。其中,C元素主要来自测试过程中所使用的导电碳胶。O,Al和Si的质量分数分别为46.57%,6.86%,5.26%,原子分数分别为42.86%,3.74%,2.76%(如表 1所示),由此可见,所制备的AL符合水铝英石(1~2SiO2·Al2O3·5~6H2O)结构[18]。
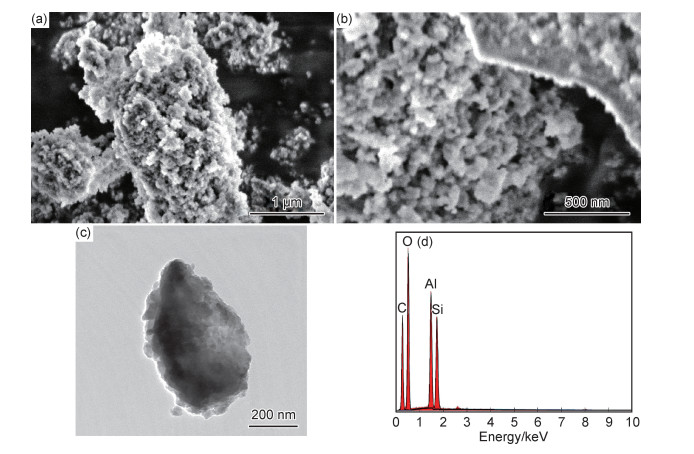
|
图 3 AL的SEM(a)和(b),TEM(c)和EDS(d)图 Fig. 3 SEM(a) and (b), TEM(c) and EDS(d) images of AL |
| Element | Mass fraction/% | Atom fraction/% | Error/% |
| C | 41.31 | 50.64 | 8.84 |
| O | 46.57 | 42.86 | 9.70 |
| Al | 6.86 | 3.74 | 5.02 |
| Si | 5.26 | 2.76 | 4.68 |
为了研究复合固态聚合物电解质PLAL中各组分之间相互作用对PEO结晶的影响,通过XRD研究了不同AL含量(0%,2%,5%和8%)时的复合固态聚合物电解质的结晶性能。图 4为不同AL含量复合固态聚合物电解质的XRD图。从图中可以看出,不同AL含量的复合固态聚合物电解质在2θ为19°和23°均表现出PEO的特征结晶衍射峰。在测试过程中样品的厚度保持不变,随AL含量从0%增加至8%,可以明显看出PEO的特征衍射峰强度先降低后升高。这一结果表明AL的引入会影响体系中PEO的结晶。当AL含量为5%时,PEO特征衍射峰强度最低,结晶被抑制的程度最明显。但是随着AL含量的增加,AL的异相成核剂的作用越来越明显,使得PEO的异相成核更容易,因此体系中PEO的结晶被抑制的作用随AL含量升高而减弱。
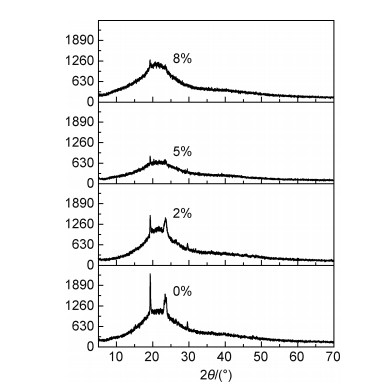
|
图 4 EO/Li+摩尔比为15:1,不同AL含量复合 固态聚合物电解质的XRD图谱 Fig. 4 XRD patterns of the composite solid polymer electrolytes with different AL contents at 15:1 of EO/Li+molar ratio |
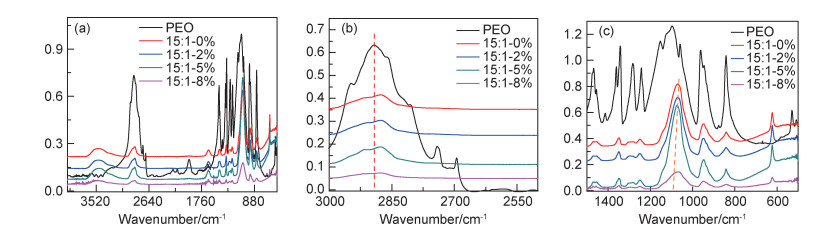
结合FTIR对组分之间的相互作用进行分析,结果如图 5所示。图 5(a)给出了PEO均聚物及不同组成复合固态聚合物电解质膜的FTIR谱图。其中,PEO均聚物的主要特征峰归属如下:1097 cm-1位置吸收峰是C—O—C伸缩振动吸收峰,而—CH2—的特征吸收峰主要出现在三个区域,2891 cm-1处为C—H伸缩振动吸收峰,1200~1500 cm-1范围内主要归属—CH2—弯曲和扭曲振动(图中1466,1361,1341 cm-1),800~1000 cm-1主要归属—CH2—摇摆振动(图中961,842 cm-1);并且,这些谱带对PEO分子链构象变化、结晶相的追踪非常敏感[19]。由图 5(a)可以看出,PEO的特征吸收峰(尤其是醚氧键的吸收峰)在复合固态聚合物电解质中发生了迁移,其具体分析如图 5(b),(c)所示。
|
图 5 PEO均聚物膜及不同组成复合固态聚合物电解质膜的FTIR谱图(a)和样品在3000~2500 cm-1(b)以及1500~500 cm-1(c)范围的红外光谱局部放大图 Fig. 5 FTIR spectra of PEO homopolymer membranes and composite solid polymer electrolyte membranes with different compositions(a) and partially enlarged FTIR spectra of sample with different compositions in the range of 3000-2500 cm-1 (b) and 1500-500 cm-1(c) |
图 5(b),(c)显示了PEO聚合物膜、不同组成复合固态聚合物电解质膜在3000~2500 cm-1以及1500~500 cm-1范围的红外光谱局部放大图。在PEO中加入锂盐后(图中黑色与红色曲线),C—H伸缩振动吸收峰从2891 cm-1迁移到2875 cm-1,而C—O—C伸缩振动吸收峰从1097 cm-1迁移到1071 cm-1,同时876 cm-1处的吸收峰消失,特征吸收峰发生了红移。由于共轭效应会造成复合体系中基团键力常数减小,导致基团特征频率红移,故在PEO分子链中的醚氧基团与Li+之间存在络合作用。这与文献[20]所报道的PEO与Li+之间的络合作用一致。
进一步分析,当加入AL后,如图 5(c)所示,C—O—C伸缩振动特征吸收峰峰位置随AL含量的增加先向高波数迁移且含量越高吸收峰峰形越宽,说明AL的加入使得聚合物电解质体系间的相互作用进一步复杂。由于AL结构中含有羟基,具有Lewis酸性质,可能与Li+发生Lewis酸-碱相互作用,从而减弱了醚氧基团与Li+的络合作用,使得相邻的C—O—C振动吸收峰向高波数迁移。此外,1100 cm-1附近的三重峰(1153,1097,1059 cm-1)、1350 cm-1附近处的双重峰(1341,1361 cm-1)以及961 cm-1位置的吸收峰通常被用来确认PEO结晶相的存在[21-22]。当加入锂盐和AL后,961 cm-1和946 cm-1处的双峰向949 cm-1的单峰转变,1100 cm-1附近处三重峰的肩峰逐渐减弱并向1071 cm-1处的单峰迁移,1350 cm-1附近处的双重峰向1349 cm-1处的单峰迁移。这说明加入锂盐和AL后,PEO的结晶被一定程度地抑制。此外,在PEO的红外光谱中,961 cm-1和842 cm-1处的吸收峰属于亚甲基基团中C—H的摇摆振动,它们的存在表明PEO的分子链呈现一种螺旋状的构象[23]。当加入AL后,961 cm-1和842 cm-1处的吸收峰强度发生不同程度的变化,说明PEO分子链的构象受到影响,可以推测AL结构中存在的羟基也可能与PEO分子端羟基形成氢键,从而限制了基团的振动,阻止了PEO分子链的有序折叠取向,抑制了PEO的结晶。这一推断与文献报道一致[24-25]。
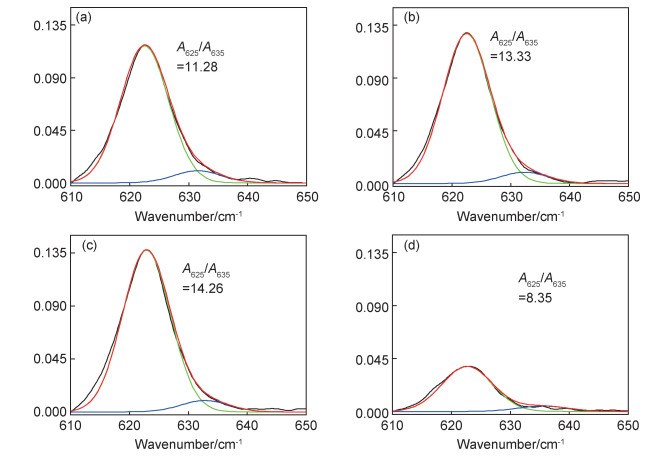
进一步利用FTIR-ATR从分子尺度上对复合固态电解质体系中的组分相互作用对锂盐解离的影响进行了研究,结果如图 6所示。依据文献[9]的报道,在FTIR谱图中≈625 cm-1和≈635 cm-1波数处的吸收峰分别对应于游离的ClO4-和Li+ClO4-相互结合的离子对的特征吸收峰。因此,LiClO4的解离程度可以利用自由离子“ClO4-”振动吸光度与离子对“Li+ClO4-”振动吸光度的相对比值来进行相对分析(即为A625/A635)。图 6(a)~(d)显示了不同AL含量复合固态聚合物电解质的FTIR-ATR光谱以及相应的拟合结果。由图中可以看出,随着AL用量的增加,A625/A635呈现先增加后减小的趋势。当AL用量达到5%时,A625/A635达到最大值为14.26。这一结果说明,AL对LiClO4的解离有影响,随AL用量的增加,体系中LiClO4的解离程度先增加后降低,在AL用量为5%时达到最大程度的解离,该变化趋势与PEO的结晶被抑制程度变化相一致。由此可以看出,AL不仅对PEO的结晶过程有影响,而且对LiClO4的解离过程也有影响,这是由于AL结构中含有羟基,具有Lewis酸性质,也可能与Li+发生Lewis酸-碱相互作用,促使LiClO4的解离。当PEO的结晶被抑制时,PEO中的无定形区域增加,与Li+的络合促进锂盐的解离,同时Li+沿PEO分子链的运动能力增强,进一步抑制PEO的结晶。
|
图 6 EO/Li+摩尔比为15:1,不同AL含量复合固态聚合物电解质在610~650 cm-1处的FTIR-ATR光谱以及相应的分峰拟合曲线 (a)0%;(b)2%;(c)5%;(d)8% Fig. 6 FTIR-ATR spectra at 610-650 cm-1 and corresponding peak fitting curves for the composite solid polymer electrolytes with different AL contents at 15:1 of EO/Li+ molar ratio (a)0%;(b)2%;(c)5%;(d)8% |
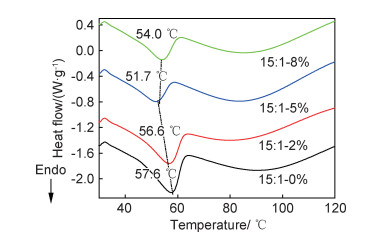
为了进一步研究PLAL中AL用量对PEO结晶度的影响,通过DSC分析了不同AL含量的复合固态聚合物电解质中PEO结晶的熔融情况。图 7为不同AL含量复合固态聚合物电解质的DSC曲线,分析了复合固态聚合物电解质体系中PEO结晶的熔点(Tm)和熔融焓(ΔHm)。从图中可以看出,当AL含量为5%及以下时,随AL含量的增加,PLAL体系中PEO的熔点由57.6 ℃降低到51.7 ℃;当AL含量在5%以上时,随AL含量的增加,PLAL体系中PEO的熔点由51.7 ℃升高到54.0 ℃。
|
图 7 EO/Li+摩尔比为15:1,不同AL含量复合 固态聚合物电解质的DSC曲线 Fig. 7 DSC curves of the composite solid polymer electrolytes with different AL contents at 15:1 of EO/Li+ molar ratio |
对不同AL含量的PLAL体系中的PEO的Tm,ΔHm以及结晶度(Χc)进行比较,结果如表 2所示。由表 2中可以看出,AL含量在0至5%之间时,PEO的结晶度由25.3%降低到14.5%。主要是由于AL和PEO之间的相互作用使PEO分子链的结晶受到抑制,结晶的片晶厚度降低,表现为体系中PEO的熔点逐渐从57.6 ℃降至51.7 ℃。当AL含量高于5%时,PEO的结晶度由14.5%升高到16.6%。这是由于无机填料的异相成核作用逐渐增强,PEO分子链结晶形成的片晶厚度增加,表现出在升温过程中PEO结晶的熔点从51.7 ℃升高至54.0 ℃。由以上分析可见,随AL含量的增加,复合固态聚合物电解质中PEO的结晶度先降低后升高,在AL含量达到5%时,结晶度最低为14.5%。体系中PEO结晶度随AL含量的变化规律与XRD结果一致。
利用光学显微镜观察了PLAL膜的形貌。图 8为不同AL含量复合固态聚合物电解质的显微镜照片。由图 8(a)可以看出,PEO晶粒较大,球晶直径约为67.5 μm,说明其在EO/Li+的摩尔比为15:1的固态电解质膜中具有较强的结晶能力。随着AL含量的增加,PEO球晶的数量和大小发生了明显变化,如图 8(b)~(d)所示。当AL含量增加到PEO质量的5%时(如图 8(c)),球晶尺寸仅为27 μm。这是由于AL的—OH与PEO链段中的氧原子形成了氢键相互作用,破坏了PEO链段的规整性抑制了PEO的结晶[24]。但随着AL含量的进一步增加,异相成核作用促进了PEO的结晶,球晶尺寸明显增大,如图 8(d)所示。

|
图 8 EO/Li+摩尔比为15:1,不同AL含量复合固态聚合物电解质的光学显微镜照片 (a)0%;(b)2%;(c)5%;(d)8% Fig. 8 Optical microscopy images of the composite solid polymer electrolytes with different AL contents at 15:1 of EO/Li+ molar ratio (a)0%;(b)2%;(c)5%;(d)8% |
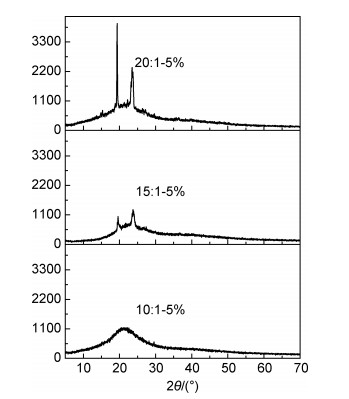
通过固定AL用量,进一步研究了不同锂盐用量对复合固态聚合物电解质中PEO的结晶性能的影响。图 9为AL含量为5%,锂盐含量不同的复合固态聚合物电解质的XRD图谱。由图可见,随着体系中LiClO4含量的增加,19°和23°处PEO的特征衍射峰峰形变宽且强度变弱,无定形态的“馒头峰”逐渐占据主导地位。当EO/Li+摩尔比为10:1时,PEO晶体的特征衍射峰完全消失,形成一个宽而弱的“馒头峰”,说明LiClO4能够有效地抑制PEO的结晶。这也说明,LiClO4通过Li+与EO单元的络合作用,可以破坏分子链的有序折叠,较好地抑制PEO的结晶。随着锂盐含量的进一步升高,PEO的结晶将被完全抑制,处于无定形态,体系为黏度较大的胶体状态,不能满足固态聚合物电解质的力学性能要求。
|
图 9 含5%的AL复合固态聚合物电解质在不同EO/Li+摩尔比下的XRD图谱 Fig. 9 XRD patterns of the composite solid polymer electrolytes containing 5% AL at different EO/Li+ molar ratio |
图 10是AL用量为5%时,不同锂盐用量复合固态聚合物电解质的DSC曲线。利用DSC对复合体系中PEO的结晶进行了热分析。随着锂盐含量的增加,PEO结晶的熔点由58.8 ℃逐渐降低至40.7 ℃,熔融峰变宽。这可能是由于锂盐含量增加,体系中PEO分子链折叠形成的片晶厚度有所减小,而且晶体结构松散、不完善造成的。依据DSC曲线上熔融峰面积对应的焓变,对样品中PEO的结晶度进行了分析,结果如表 3所示。由表中数据可见,随着锂盐含量的增加,复合固态聚合物电解质中PEO的结晶度逐渐降低,当EO/Li+摩尔比为10:1时,PEO结晶度仅为4.12%。这一结果与XRD结果相一致,说明锂盐与PEO的络合抑制了体系中PEO的结晶。
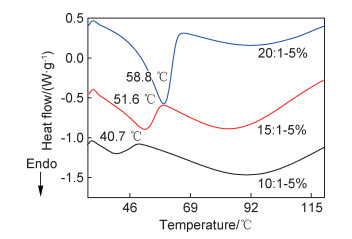
|
图 10 含5%的AL复合固态聚合物电解质在不同EO/Li+摩尔比下的DSC曲线 Fig. 10 DSC curves of the composite solid polymer electrolytes containing 5% AL at different EO/Li+ molar ratio |
| EO/Li+ molar ratio | AL/% | Tm/℃ | ΔHm/(J·g-1) | Χc/% |
| 10:1 | 5 | 40.7 | 8.12 | 4.12 |
| 15:1 | 5 | 51.7 | 28.62 | 14.5 |
| 20:1 | 5 | 58.8 | 67.19 | 34.1 |
图 11为不同锂盐含量时复合固态聚合物电解质的显微镜照片。由图可以看出,当EO/Li+摩尔比为10:1时(图 11(a)),由于锂盐的异相成核作用,PEO晶核密度较大,晶体生长空间较小,形成的球晶尺寸细小而均匀,最大球晶尺寸仅为12 μm;当EO/Li+摩尔比增加到15:1和20:1时,锂盐含量小,异相晶核密度较小,PEO球晶的空间生长较大,形成的球晶尺寸分别为30 μm和35 μm,如图 11(b),(c)所示。这一形貌结果表明,锂盐LiClO4的加入起到了异相成核作用,较大的加入量可以抑制PEO结晶生长。
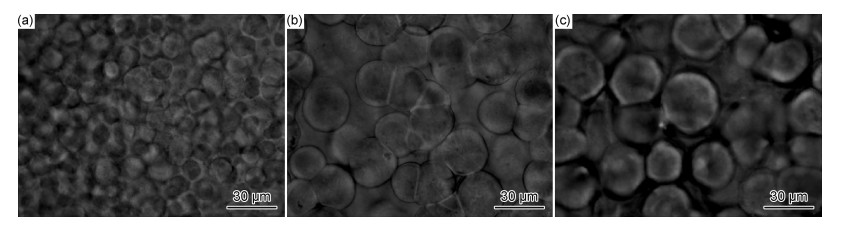
|
图 11 含5%的AL复合固态聚合物电解质在不同EO/Li+摩尔比下的光学显微镜照片 (a)10:1;(b)15:1;(c)20:1 Fig. 11 Optical microscopy images of composite solid polymer electrolytes containing 5% AL at different EO/Li+ molar ratio (a)10:1;(b)15:1;(c)20:1 |
(1) 通过溶胶-凝胶法制备得到AL,具有水铝英石(1~2SiO2·Al2O3·5~6H2O)结构。
(2) AL中的—OH与PEO链段形成了氢键相互作用,抑制了PEO的结晶。
(3) AL与Li+发生Lewis酸-碱相互作用,促使了LiClO4的解离。Li+与EO单元的络合作用,较好地抑制PEO的结晶。
(4) 当EO/Li+摩尔比为10:1,AL的含量为5%时,AL和LiClO4与PEO间的非价键力相互作用使PEO结晶度最小,PEO最大球晶尺寸为12 μm。
| [1] |
袁琦, 邹正光, 万振东, 等. 锂离子电池正极材料铁掺杂V6O13的制备及电化学性能[J]. 材料工程, 2018, 46(1): 106-113. YUAN Q, ZOU Z G, WAN Z D, et al. Synthesis and electrochemical properties of Fe-doped V6O13as cathode material for lithium-ion battery[J]. Journal of Materials Engineering, 2018, 46(1): 106-113. |
| [2] |
ZHANG J, ZHAO J, YUE L, et al. Safety-reinforced poly (propylene carbonate)-based all-solid-state polymer electrolyte for ambient-temperature solid polymer lithium batteries[J]. Advanced Energy Materials, 2015, 5(24): 1501082. DOI:10.1002/aenm.201501082 |
| [3] |
JIANG Y, YAN X, MA Z, et al. Development of the PEO based solid polymer electrolytes for all-solid state lithium ion batteries[J]. Polymers, 2018, 10(11): 1237. DOI:10.3390/polym10111237 |
| [4] |
DENG F, WANG X, HE D, et al. Microporous polymer electrolyte based on PVDF/PEO star polymer blends for lithium ion batteries[J]. Journal of Membrane Science, 2015, 491(19): 82-89. |
| [5] |
POLU A R, RHEE H W. Nanocomposite solid polymer electrolytes based on poly (ethylene oxide)/POSS-PEG (n=13.3) hybrid nanoparticles for lithium ion batteries[J]. Journal of Industrial and Engineering Chemistry, 2015, 31(11): 323-329. |
| [6] |
ZHAO Y, BAI Y, BAI Y, et al. A rational design of solid polymer electrolyte with high salt concentration for lithium battery[J]. Journal of Power Sources, 2018, 407(35): 23-30. |
| [7] |
ARMAND M. Polymer solid electrolytes-an overview[J]. Solid State Ionics, 1983, 9(1): 745-754. |
| [8] |
梁波. 锂离子电池安全性能研究[M]. 长沙: 中南大学出版社, 2014: 18-19. LIANG B. Research on the safety performance of lithium-ion batteries[M]. Changsha: Central South University Press, 2014: 18-19. |
| [9] |
LIM D, LIU W, LIU Y, et al. High ionic conductivity of composite solid polymer electrolyte via in situ synthesis of monodispersed SiO2 nanospheres in poly (ethylene oxide)[J]. Nano Letters, 2015, 16(1): 459-465. |
| [10] |
MASOUD E M, HASSAN M E, WAHDAAN S E, et al. Gel P(VDF/HFP)/PVAC/lithium hexafluorophosphate composite electrolyte containing nano ZnO filler for lithium ion batteries application: effect of nano filler concentration on structure, thermal stability and transport properties[J]. Polymer Testing, 2016, 56(8): 277-286. |
| [11] |
SUN Z, LI Y, ZHANG S, et al. G-C3N4nanosheets enhanced solid polymer electrolytes with excellent electrochemical performance, mechanical properties, and thermal stability[J]. Journal of Materials Chemistry A, 2019, 7(18): 11069-11076. DOI:10.1039/C9TA00634F |
| [12] |
YANG J, WANG X, ZHANG G, et al. High-performance solid composite polymer electrolyte for all solid-sate lithium battery through facile microstructure regulation[J]. Frontiers in Chemistry, 2019, 7: 388. DOI:10.3389/fchem.2019.00388 |
| [13] |
HYUN W J, DE MORAES A C M, LIM J M, et al. High-modulus hexagonal boron nitride nanoplatelet gel electrolytes for solid-state rechargeable lithium-ion batteries[J]. ACS Nano, 2019, 13(8): 9664-9672. DOI:10.1021/acsnano.9b04989 |
| [14] |
SHENG O, JIN C, LUO J, et al. Mg2B2O5 nanowire enabled multifunctional solid-state electrolytes with high ionic conductivity, excellent mechanical properties, and flame-retardant performance[J]. Nano Letters, 2018, 18(5): 3104-3112. DOI:10.1021/acs.nanolett.8b00659 |
| [15] |
PRZYLUSKI J, SIEKIERSKI M, WIECZOREK W, et al. Effective medium theory in studies of conductivity of composite polymeric electrolytes[J]. Electro Chimica Acta, 1995, 40(13/14): 2101-2108. |
| [16] |
WIECZOREK W, FLORJANCZYK Z, STEVENS J R. Composite polyether based solid electrolytes[J]. Electro Chimica Acta, 1995, 40(13/14): 2251-2258. |
| [17] |
DU P, YUAN P, THILL A, et al. Insights into the formation mechanism of imogolite from a full-range observation of its sol-gel growth[J]. Applied Clay Science, 2017, 150(16): 115-124. |
| [18] |
袁鹏, 杜培鑫, 周军明, 等. 铝硅酸盐纳米矿物的地质意义和资源价值再认识[J]. 岩石学报, 2019, 35(1): 164-176. YUAN P, DU P X, ZHOU J M, et al. Insights into the geological and resource significance of aluminosilicate nanominerals[J]. Acta Petrologica Sinica, 2019, 35(1): 164-176. |
| [19] |
WEN S J, RICHARDSON T J, GHANTOUS D I, et al. FTIR characterization of PEO+LiN(CF3SO2)2 electrolytes[J]. Journal of Electroanalytical Chemistry, 1996, 408(1/2): 113-118. |
| [20] |
XUE Z, HE D, XIE X L, et al. Poly (ethylene oxide)-based electrolytes for lithium-ion batteries[J]. Journal of Materials Chemistry:A, 2015, 3: 19218-19253. |
| [21] |
LI X, HSU S L. An analysis of the crystallization behavior of poly (ethylene oxide)/poly (methyl methacrylate) blends by spectroscopic and calorimetric techniques[J]. Journal of Polymer Science: Polymer Physics Edition, 1984, 22(7): 1331-1342. DOI:10.1002/pol.1984.180220715 |
| [22] |
金兰英, 姜艳霞, 廖宏刚, 等. 红外光谱研究PEO基离子液体聚合物电解质[J]. 高等学校化学学报, 2009, 30(4): 767-771. JIN L Y, JIANG Y X, LIAO H G, et al. FTIR spectroscopic studies of PEO-based polymer electrolyte with ionic liquid[J]. Chemical Journal of Chinese Universities, 2009, 30(4): 767-771. |
| [23] |
甄冉, 迟茜文, 王星元, 等. 聚氧化乙烯/高岭石聚合物电解质的制备与表征[J]. 高分子学报, 2017, 8(8): 1312-1319. ZHEN R, CHI Q W, WANG X Y, et al. Preparation and characterization of poly (ethylene-oxide)/Kaolinite composite electrolyte[J]. Acta Polymerica Sinica, 2017, 8(8): 1312-1319. |
| [24] |
甄冉.粘土/聚氧化乙烯聚合物固体电解质的制备与表征[D].长春: 吉林大学, 2017. ZHEN R. Preparation and characterization of clay/poly ethylene oxide polymer solid electrolyte system[D]. Changchun: Jilin University, 2017. |
| [25] |
MPOFU P, ADDAI-MENSAH J, RALSTON J, et al. Temperature influence of nonionic polyethylene oxide and anionic polyacrylamide on flocculation and dewatering behavior of kaolinite dispersions[J]. Journal of Colloid and Interface Science, 2004, 271(1): 145-156. |
| [26] |
汪勋, 杨晶晶, 邵乐, 等. 一种高离子电导率复合聚合物电解质的简易热处理制备[J]. 中国科学:化学, 2019, 49(2): 360-367. WANG X, YANG J J, SHAO L, et al. A facile preparation of composite polymer electrolyte with high ionic conductivity by thermal treatment[J]. Scientia Sinica Chimica, 2019, 49(2): 360-367. |
 2021, Vol. 49
2021, Vol. 49


