文章信息
- 张福明, 王静, 张鹏, 时志强
- ZHANG Fu-ming, WANG Jing, ZHANG Peng, SHI Zhi-qiang
- 有机电解液在钠离子电池中的研究进展
- Research progress of organic electrolyte for sodium ion battery
- 材料工程, 2021, 49(1): 11-22
- Journal of Materials Engineering, 2021, 49(1): 11-22.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2019.001121
-
文章历史
- 收稿日期: 2019-12-03
- 修订日期: 2020-10-30
2. 天津市先进纤维与储能技术重点实验室, 天津 300387
2. Tianjin Key Laboratory of Advanced Fiber and Energy Storage Technology, Tianjin 300387, China
随着技术的飞速发展,储能系统(energy storage system, ESS)对于支持智能设备和电动汽车至关重要。面临环境污染、资源短缺等问题,储能系统的发展如太阳能、风能、可再生能源等不仅满足人民日益增长的需求,而且彻底地改善了人们的生活[1-3]。能源生产和存储技术在日常应用中引起了极大的关注。在近几十年中,锂离子电池(lithium ion battery, LIB)技术的发展在全球范围内提高了人们的生活标准。LIB在大多数移动电子设备方面的大规模应用,推动了锂离子电池行业的快速发展。此后,由于特斯拉的带动,锂离子电池又逐渐进入电动汽车领域。然而,越来越多地涉及可再生能源、智能电网,锂的资源可利用性以及后续预期价格增加的问题将或多或少地限制其在未来的应用[4-5]。因此,LIB是否能够满足未来中小型或者大规模储能应用的需求还不清楚。由于钠的资源丰富、低成本,钠离子电池(sodium ion battery, SIB)被认为是下一代具有潜力的能源资源,成为未来最先进的锂离子电池的替代品。钠的电化学当量和标准电位是继锂之后最有利于钠电池应用的,钠离子电池储能逐渐开始在多方面得到发展。锂离子电池存在天然的成本和安全的天花板,钠离子半径0.102 nm相对于锂离子半径0.076 nm要大34.2%, 导致钠离子不适合在传统的石墨负极材料中进行储能,所以对于钠离子电池,要有针对性地选择适合钠离子储能的材料和可以解决其稳定性等问题的方法从而达到满足钠离子电池长期目标应用[6-8]。因此,硬碳被认为是一种最合适的负极材料,不同炭化温度、时间等工艺条件可以调控硬碳的层间和结构从而满足其储钠要求,目前其容量可以达到250~400 mAh·g-1的稳定范围。虽然通过硬碳的结构改性、钝化、界面组分等研究方法对储钠机理进行了评价,但在理想条件下,理论容量还远远达不到理想状态下(>530 mAh·g-1)的水平。根据大量研究发现,酯基电解液如碳酸乙烯酯(EC)、碳酸二甲酯(DMC)、碳酸二乙酯(DEC)、碳酸丙烯酯(PC)等由于其在充放电过程发生极化效应使电解液在负极表面发生严重的降解,生成粗糙、不均匀、较厚的固体电解质界面(solid electrolyte interface, SEI),导致不可逆反应的发生,从而影响了倍率性能、首次库仑效率和长循环稳定性等。相反,近几年的研究发现醚基电解液可以改善硬碳等材料在钠离子电池当中的应用[9-10]。基于此,本文依次综述了钠离子电池电解质的基本要求、主要分类,着重讨论了对于有机电解液中钠盐和溶剂选择的重要性包括其物化性能、与负极材料的兼容性、对固体电解质界面的影响等,针对性地分析讨论了有机电解液中醚类溶剂和酯类溶剂对负极材料(尤其是碳基材料包括石墨、硬碳等)及其固体电解质界面的影响。最后对钠离子电池电解质未来的发展进行展望。
1 钠离子电池电解液的基本要求电解液是锂/钠离子电池的关键材料之一,在电池正负极之间起到传导和输送能量的作用,是其具备高电压、高比能等优点的保证,其成本约占总成本的5%~10%左右。成分主要由盐、溶剂和添加剂组成。一个好的电解质可以提供良好的电导率和离子的扩散率,大大减少副反应,并提供稳定的性能[11]。
在SIB体系中,电解质是发生电化学反应所必需的离子电荷载体。理想的情况下,盐/溶剂的结合必须满足高离子电导率, 在宽的电势范围内具有电化学稳定性和化学稳定性、良好的热稳定性、低成本、工艺简单、低毒性和环境友好型等特点[12]。从钠离子电池的基本要求和特殊要求进行具体详细的讨论:(1)对于离子电导率,其中电解液的电导率和黏度是影响电池电化学性能的关键因素,离子电导率取决于盐的解离度、溶剂黏度、钠离子数以及阴离子数目等。离子电导率低或黏度高的电解质在高电流密度或低环境温度时往往表现出较差的循环稳定性。(2)对于化学/电化学稳定性,电解液耐分解成副产物的能力也至关重要,这一因素将直接影响固体电解质界面的形成从而导致较慢的离子迁移速度、较高的极化程度和电荷载流子的损失,这些都是加速电池失效的因素。(3)对于热稳定性,传统的有机溶剂因为热分解温度较低而工作温度范围大而受限,通常研究者选择不燃磷酸盐、离子液体和固态电解质解决此问题[13-15]。
除了这些基本要求之外,为了满足钠离子电池高能量密度、长循环稳定性等要求,对电解液的设计又提出了以下特殊要求:(1)SIB电解液不仅要考虑高电导率和大的钠离子迁移数,还要考虑其热稳定性、经济效益和固体电解质界面的稳定性。(2)电解液在不同电极表面产生的SEI层具有不同的组成和性质,从而影响SIB的电化学稳定性,工业生产要注重电解液与电极的匹配。(3)对一系列电解液在不同体系下进行基础性的实验,通过先进的表征与模拟计算来探索溶剂的离子尺寸、溶剂化离子尺寸和LUMO-HOMO值等,这些参数将会影响在不同结构材料中的储钠机制。(4)应更集中地针对电解液的离子传输进行研究,界面性质与电极表面的钠化合物(NaCx)的形成密切相关,这会表现出不同的离子电导特性和机械强度等特征。
因此,在商业上可行的钠离子电池电解液须满足以上标准,从而实现钠离子电池在市场上的高效利用。
2 钠离子电池电解液的分类和锂离子电池相似,钠离子电池电解质主要分为液体电解质、固液复合电解质和固体电解质三大类,如图 1所示。其中液体电解质又分为有机液体电解质、水系电解质和离子液体电解质。固体电解质分为无机固体电解质和固体聚合物电解质。液体电解质又被分为酯基和醚基电解液,其溶剂化效应和电场驱动被认为是影响Na+迁移的主要因素[16],而聚合物中的链段运动和空位迁移被认为是影响Na+在固体电解质和凝胶电解质中的移动的因素[17]。

|
图 1 钠离子电池电解质的分类 Fig. 1 Classification of electrolytes for sodium ion batteries |
一般情况下,液体电解质的离子电导率高于固体电解质,因为它们具有较好的流动性,有利于钠离子的快速迁移。在液体电解质中有机系根据溶剂的不同分为酯类和醚类电解液,两者的区别主要在于对固体电解质界面形成特点及在不同负极材料中的储能机制不同[18]。水系电解液通常被认为是低成本、环境友好型的体系,然而其有限的电化学窗口限制其在大能量密度和高功率密度条件下的应用。水系电解液的电化学稳定窗口(electrochemical stability window, ESW)因为析氢吸氧反应而受限,有机电解液的ESW主要受限于溶剂的选择,不同溶剂所能承受的电化学窗口是不同的。通常提高ESW的方法是使用离子液体、聚合物和无机固态电解质。近几年也有研究者将目标放在高浓度盐电解质上来提高电化学稳定性[19-21]。液体电解液中的离子液体又称室温熔盐或常温熔体,仅由阳离子和阴离子组成,是非挥发性的、不可燃的, 可在宽的温度范围内使用, 并且具有优异的热稳定性和化学稳定性等特点, 在各种领域都有潜在的应用,包括化学合成、真空技术和摩擦学领域[22-23]。离子液体因其具有较高的电化学窗口和优异的热稳定性而被广泛关注,但是离子液体的高黏度和高成本问题限制了其在储能领域的应用[24-25]。
2.2 固液复合电解质固液复合电解质通常被称作凝胶聚合物电解质(gel polymer electrolytes, GPEs),主要由聚合物、增塑剂以及钠盐等组成,在钠离子电池中可以充当隔膜和离子导电载体。其相对于液体电解质,电导率较低,但是安全性较高。钠离子电池中的常用隔膜为玻璃纤维(glass fiber, GF),由于GF疏松的编织中空结构和极高的孔隙率,电极之间的直接连接可能导致热失效和爆炸等安全隐患,而未优化的孔径可能导致离子迁移率受阻,容量衰减。而凝胶聚合物电解质具有类似液体电解质的优异的扩散特性和类似聚合物的较强的黏着力,表现出较高的离子导电性、优越的加工性能和良好的机械强度[26]。目前,用于钠离子电池中的凝胶聚合物体系较少,用电化学稳定的聚合物对GF进行改性似乎是一种典型的、简单的改善纤维转化的方法。常见的GPEs主要有聚偏氟乙烯-六氟丙烯(PVDF-HFP)[27-28]、聚甲基丙烯酸甲酯(PMMA)[29]、聚丙烯腈(poly(acrylonitrile))[30]和聚环氧乙烷(PEO)[31]。其中聚偏氟乙烯-六氟丙烯(PVDF-HFP)共聚物在SIB工作电压窗口下具有良好的热稳定性和电化学稳定性,是GF的代表性涂层材料。虽然凝胶聚合物电解质在一定程度上解决了液体电解质易燃等安全性问题,但是其离子电导率和与电极的界面关系仍是科学工作者需要考虑的问题。
2.3 固体电解质固体电解质通常被用来解决液体电解质等存在的安全性问题,因为它们具有不易燃性,良好的热稳定性、力学性能,较高的钠离子迁移数(≈1)和宽的ESW(≈5 V)。当这些固体电解质应用于钠离子电池时,可以获得优异的能量密度和宽的工作温度范围。因此,固体电解质的研发是提高电池电化学性能和安全性的关键。尽管钠离子电池固体电解质已经进行了多年的研究[32],但问题仍然存在,如界面兼容性、钠离子转移屏障和制造工艺。必须克服这些界面不稳定、离子迁移困难和制备工业困难等问题,才能实现大规模应用。
3 电解质钠盐的选择钠盐是钠离子电池组成中不可缺少的组成部分,对电池的最终性能有着深远的影响。和锂离子电池相似,电解质钠盐是提供钠离子的源泉,保证电池在充放电循环过程中有足够的钠离子在正负极材料来回往返,从而实现可逆循环。因此必须保证电极与电解液之间没有副反应发生。理想的钠盐应具有在电解质中完全溶解和解离的能力,其中溶解的离子,特别是钠离子,可以在没有能量和动能障碍的情况下运动。此外,钠盐应该保持对电池其他组分具有电化学惰性的特点,例如电极、隔膜和集流体等[33-34]。通常被应用的钠盐及其相关物理和化学性能如表 1[35-36]所示。
早期NaClO4和NaPF6盐是最常被研究的两种钠盐,2000年,Stevens等用1 mol·L-1NaClO4在EC:DEC(体积比3:7)中研究室温下钠离子在硬碳结构中的可逆插层[37]。Ricardo等报道了分别以NaPF6和NaClO4盐溶于EC:DMC(体积比1:1)的混合溶剂的电解液中,炭质材料对其两种盐的依赖性[38]。Komaba等系统地研究了一种二元溶剂,即EC,PC,碳酸丁烯(BC),DMC和DEC在不同组合中的混合[39]。NaClO4和NaPF6盐均存在劣势,其中NaClO4是一种难于干燥且易制爆的盐,NaPF6对水很敏感,很容易产生高度腐蚀性的氢氟酸(HF),产生的HF可以与固体电解质界面(SEI)的碱性成分反应,然后通过促进电池系统生成较多的有害气体来削弱刚性的SEI膜,这两种盐是钠离子电池中最常用的体系,使用NaClO4基电解液作为碳质电极具有较高的容量和较高的库仑效率[40-41]。相对于传统的NaClO4和NaPF6盐,含氟磺酰基团的钠盐(NaTFSI, NaFTFSI, NaFSI等)虽然具有较高的热稳定性和无毒的特点,但是很少单独被用作钠盐来使用,这主要归因于其阴离子对铝箔集流体具有腐蚀作用[40]。Eshetu等[40, 42-43]报道了一系列钠盐NaX(X=PF6,ClO4,TFSI,FTFSI,FSI)的热稳定性及其对钠碳化合物(Nax-HC)的热稳定性研究,如图 2(a),(b)所示。图 2(a)的热重分析表明,纯盐的热稳定性依次为NaClO4>NaTFSI>NaPF6>NaFTFSI>NaFSI,其中NaClO4的热稳定性最佳。然而NaClO4由于其易制爆的特点一定程度地限制其应用。相反,NaPF6直至300 ℃几乎没有质量损失,因此除了本质的安全性问题,NaPF6被认为是较常用的钠盐。图 2(b)中硬碳(HC)电极在不同钠盐的EC:DEC(体积比为1:1)基电解液中的恒电流放电曲线。对比在锂离子电池中的报道[42],释放的热量是插入程度(电荷状态,SOC)的函数,特别是对于LixC6中x的较低值,这在钠离子电池Nax-HC可能有相同的作用。因此,所有碱化的HC都保持在几乎相同的容量,以确保对电解质的固有反应性进行现实的比较。同时,钠盐的降解在电极表面形成的保护层对其电化学稳定性也极为重要。Eshetu等[43]利用不用Ar刻蚀深度XPS测试技术研究了电解质盐阴离子对钠离子电池固体电解质界面形成的影响。用无黏结剂和添加剂的HC对SEI膜进行XPS分析,排除了除活性物质以外的杂质干扰,在283 eV处出现的峰的强度可以直接作为SEI膜厚度的参数。结果表明相比于NaPF6和NaTFSI基电解液,以NaClO4作为钠盐的电解液在HC表面形成更厚的SEI膜。其表面成分主要由电解液溶剂降解产生的有机物质组成的,而SEI膜深层主要由钠盐降解产生的无机物组成。其成分减少的顺序为NaPF6>NaClO4>NaTFSI>NaFTFSI>NaFSI。总之,对于钠盐的选择不仅要考虑钠盐本身的物化性能包括黏度、电导率、热稳定性等,还需要考虑其与溶剂混合后与电极的兼容性包括电化学稳定性及对电极电解液界面的热稳定性等因素。
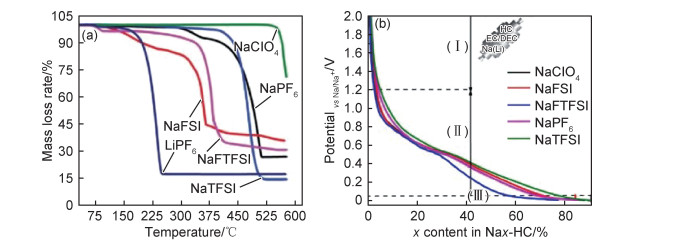
|
图 2 不同钠盐的物化性能及在其硬碳体系中的电化学性能分析图[40] (a)NaPF6,NaClO4,NaTFSI,NaFTFSI,NaFSI和LiPF6的热重分析(TGA)图谱;(b)不同Na盐在EC/DEC基电解质中HC电极的恒电流放电曲线 Fig. 2 Images of physichemical properties of different sodium salts and their electrochemical properties applied in HC systems[40] (a)thermogravimetric analysis (TGA) profiles of NaPF6, NaClO4, NaTFSI, NaFTFSI, NaFSI and LiPF6; (b)galvanostatic discharge profile of HC electrodes in EC/DEC-based electrolytes with different Na salts |
无论是作为钠离子电池的负极还是正极,材料的性能不仅仅取决于材料本身的结构,还受到SEI膜的影响。电解液在电极表面降解形成的SEI膜起到防止电解液二次还原降解和动力学不稳定性的作用[11, 44]。SEI膜通常要具备的特点如下:(1)作为一种绝缘体阻止电子转移防止电解液的继续氧化还原反应;(2)较高的阳离子选择性和可忽略的溶剂渗透性,从而阻止电极与电解液的直接接触;(3)在电池的化学和电化学环境中表现出不溶性和惰性;(4)具有更薄、致密、均匀的特点。Soto等描述了钠离子从电解质中通过SEI层嵌入到电极中的模型,可分为4个部分[45]:首先溶剂化钠离子被传送到电极外表面附近;随后,这些钠离子在脱溶剂后形成自由离子,并且扩散到液体电解质中的多孔聚合物结构中;在第三步中,部分钠离子被致密的无机层捕获产生一些Na2CO3或者NaF等化合物沉积在电极表面,这一过程是一个不可逆的过程,会导致较低的库仑效率;最后钠离子在电极材料结构中的插层反应对应着可逆的钠储存过程。所以,钠离子在通过SEI膜时产生的能垒是影响反应动力学的主要因素。
4.2 碳酸酯类电解液最常用的烷基碳酸酯溶剂主要基于两种类型的碳酸酯,一种是环状碳酸酯溶剂,如碳酸乙烯酯(EC)、碳酸丙烯酯(PC);另一种是链状碳酸酯溶剂如碳酸二乙酯(DEC)、碳酸二甲酯(DMC)和碳酸甲乙酯(EMC)[11]。它们的物理和化学性质如表 2所示。介电常数和黏度的参数均在25 ℃条件下获取。
| Solvent | Chemical structure | Melting point Tm/℃ |
Boiling point Tb/℃ |
Flashing point Tf/℃ |
Viscosity (25 ℃) |
Dielectric constant (25 ℃) |
HOMO/ eV |
LUMO/ eV |
| EC | 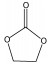
|
36.4 | 248 | 160 | 2.1 | 89.78 | -0.258 | -0.017 |
| PC | 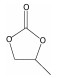
|
-48.8 | 242 | 132 | 2.53 | 64.92 | -0.254 | -0.014 |
| DEC | 
|
-74.3 | 126 | 31 | 0.75 | 2.805 | -0.242 | -0.003 |
| DMC | 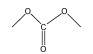
|
4.6 | 91 | 18 | 0.59 | 3.107 | -0.248 | -0.009 |
| EMC | 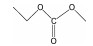
|
-53 | 110 | - | 0.65 | 2.958 | -0.245 | -0.006 |
在所有的酯类溶剂中,EC因为其优点而成为最重要的溶剂之一。溶剂的介电常数是衡量其极性的重要参数,一般情况下介电常数越大极性越小,对于极性分子,EC与钠盐通过强偶极-偶极分子间作用力相互作用,从而使盐在含EC的电解质中理想地溶解。同时,EC可以有效地在负极表面形成一层保护层,但是由于其熔点较高(36.4 ℃),在室温下是固体状态限制了其单独作为溶剂的使用,所以通常将EC与其他有机溶剂(如PC, DEC, DMC,EMC)进行混合来改善电解液的离子电导率、黏度、电化学稳定性等[46-47]。Ponrouch等[36]报道了在离子电导率方面,以EC为最佳,虽然不适合作为单独溶剂,但大大提高了二元溶剂混合物的电导率。他们评价了电解质的基本性质如黏度、离子电导率、热稳定性,以及对于含氟基和高氯酸根阴离子的钠盐的研究。其中以NaClO4为钠盐与不同溶剂混合的电解液的电化学窗口和热稳定性如图 3(a)所示,在所有研究的电解质配方中,1 moL·L-1 NaPF6在EC:PC(体积比1:1)溶剂中具有最佳的热稳定性,此外,以硬碳为负极的钠离子电池,几种电解液充分被还原后DSC测试如图 3(b)所示。DSC曲线表明添加了NaPF6盐的EC:PC溶剂的热稳定性高于其他盐或其他电解液体系。比较每种溶剂混合物和盐的反应性特点,必须考虑3个参数:放热起始温度(与SEI层破裂有关);释放最大热的温度;电极/电解质反应产生的总热量ΔH (J·g-1)。结果显示:以EC:PC(体积比1:1)为溶剂时的电解液,硬碳负极在其体系循环后形成最稳定的SEI膜。第一放热峰起始位置为156.2 ℃,并产生较低的热能717.2 J·g-1。同时以NaPF6作为钠盐,以EC和PC与不同溶剂混合作为溶剂,同样表明,EC:PC(体积比1:1)基溶剂体系硬碳具有最好的循环稳定性如图 3(c)所示。

|
图 3 不同混合溶剂的物化性能及在硬碳体系中循环稳定性图[36] (a)基于NaClO4盐溶于不同溶剂的电化学窗口稳定性和热稳定性;(b)不同电解质配方中嵌钠碳化合物的DSC加热曲线;(c)不同溶剂配方电解液对应的长循环性能 Fig. 3 Images of physichemical performance of different mixed solvents and their cycling stability in HC systems[36] (a)electrochemical potential window stability and thermal stability of electrolytes based NaClO4 dissolved in various solvents; (b)DSC heating curves of fully sodiated hard carbon in various electrolyte formulations; (c)cycling performance of different solvent formulations for the corresponding cells |
通过理论模拟和实验研究,对有机液体电解质的物理化学性质和电化学性能进行研究也至关重要。根据分子动力学模拟(MD)和离散傅里叶变换(DFT)计算Na+与烷基碳酸酯电解质的溶剂化趋势,在环状溶剂(EC,VC,PC和BC)和非环状溶剂(DMC,EMC和DEC)中的HOMO-LUMO能量差值随着它们与Na+相互作用而增加。然而,由于Na+和EC分子的优先配位作用,当EC与PC,DMC和EMC共溶剂时,HOMO-LUMO能值差减小。通常情况下这种能值差代表了溶剂分子能够承受电化学电压范围的大小。利用这种分子模拟方法可以很容易地通过调整不同物理化学性质的溶剂与炭材料来推断离子储存、扩散的方式,以及对充放电循环过程中的容量进行调控[48]。由于Li+与Na+的离子尺寸、溶剂能量、还原电势的不同导致其产生的SEI过程及成分等有明显的区别。许多关于SIB的SEI的研究都集中在与电池的性能相关以及SEI的组成、形貌和结构的表征上。离子传输是SEI层的主要功能之一,离子在SEI中的传输直接影响到电池的可逆性、倍率性能以及效率。许多报道认为传统电解质在使用碳酸酯类溶剂(EC,PC,DMC,DEC等)时更容易在负极表面发生降解产生较厚且不均匀的SEI膜,导致严重的极化现象,首次库仑效率较低,循环稳定性差等[49-50]。Komaba等[39]采用飞行时间二次离子质谱仪(TOF-SIMS)法测试表征SEI膜成分信息。一些关于无机组成的峰值可以被观察到,且强度要比在锂电中的大。例如m/z=62(Na2O+), 63(Na2OH+), 65(Na2F+), 81(Na2Cl+), 85(Na3O+), 107(Na3F2+), 129(Na3CO3+)。相反大量关于有机成分的峰值在锂电中的强度要比在钠电中大,例如m/z=51(C4H3+), 77(C2H5O3+), 127(C2H2O5Li3+), 133(C3H7O3LiCl+), m/z =59(Li3F2+),81(Li3CO3+)。SEI膜的成分是决定其发挥功能的主要因素之一,SIB中的SEI层主要由Na2O,NaCl,NaF等无机化合物组成。相比之下,LIB中的SEI层主要由有机盐组成[24, 37]。
从上述分析结果得出对于碳酸酯类溶剂,EC作为一种有益的成膜剂往往被选择与其他溶剂混合使用,溶剂的电化学窗口、热稳定性、与钠盐的匹配、对固体电解质界面的影响,以及对形成SEI膜的成分检测方法是要考虑的因素。同时由于酯类电解液在负极表面的严重降解会影响其电化学性能也是许多科学工作者目前正在解决的问题。
4.3 醚类电解液在锂离子电池中,醚类电解液很少被作为电解质使用,因为它们在阳极上钝化能力差,在超过4 V以上的工作电压下不稳定[11]。然而,近年来,在钠离子电池领域中,醚类电解质已经被广泛地使用,因为它们在钠电体系中具有更好的抗氧化还原能力,相比酯类电解质其可以在负极表面生成更薄和具有稳定的SEI膜和高的首次库仑效率[49]。醚类溶剂通常根据含有氧原子数目和链长分为1,3-二氧戊环(DOL)、乙二醇二甲醚(DME)、二乙二醇二甲醚(Diglyme)和四乙二醇二甲醚(Triglyme)4种,它们的物化性能如表 3所示。介电常数和黏度的参数均在25 ℃条件下获取。
| Solvent | Chemical structure |
Melting point Tm/℃ |
Boiling point Tb/℃ |
Flashing point Tf/℃ |
Viscosity (25 ℃) |
Dielectric constant (25 ℃) |
HOMO/ eV |
LUMO/ eV |
| DOL | 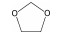
|
-95 | 74 | 1.7 | - | - | - | - |
| DME | 
|
-58 | 84 | 0 | 0.46 | 7.18 | -0.213 | 0.042 |
| Diglyme | 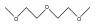
|
-64 | 162 | 57 | 1.06 | 7.4 | -0.213 | 0.033 |
| Triglyme | 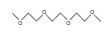
|
-46 | 216 | 111 | 3.39 | 7.53 | -0.214 | 0.028 |
对于锂离子电池而言,通常在有机碳酸盐电解质中观察到高度多孔和树枝状的锂沉积形态,由于过多的副反应导致非常低的库仑效率,并且由于枝晶穿透而产生潜在的安全隐患。相反,醚类溶剂在用于锂离子电池的各种其他潜在电解质中如LiDFOB,LiFSI,LiFSI等,一直被认为是有吸引力的,因为它们具有更好的锂金属还原稳定性。它们通过抑制枝晶生长、提高热稳定性和拓宽ESW在电解质中发挥着特殊的作用[51-52]。对于钠离子电池而言,乙二醇二甲醚(DME)、二乙二醇二甲醚(Diglyme)由于其较优异的物化性能,在该体系中溶剂化钠共插层效应和钠离子优异的扩散动力学效应而被广泛应用于钠离子电池电解质中。由于醚类溶剂成为钠离子电池形成功能性SEI膜的关键溶剂,所以近期很多研究从多个角度报道了酯类和醚类电解液在钠离子电池中形成SEI的区别[53]。Kim等比较了溶解在几种醚基溶剂(DME,Diglyme,Triglyme)中的不同钠盐(NaPF6,NaClO4,NaCl3SO3)用于石墨负极的电化学性能[54]。由于与石墨微晶片层间的层间距相比,钠离子半径较大,Na+插入石墨阳极是很困难的, Na+在石墨中的嵌入是热力学不稳定的,因为需要额外的能量来克服相邻石墨层间的范德华力的相互作用,石墨负极对钠离子储存表现出有限的电化学行为。然而,当使用醚类电解质时,可以观察到高度可逆性和快速的脱嵌行为[55-56]。相比于酯类电解液中钠离子需要完全脱溶剂化才可以进入石墨层间,在醚类电解液中钠离子可以以溶剂化的形式共插层进入石墨层间,层间的拓展有利于尺寸较大的钠离子进行储存,通过透射电子显微镜和傅里叶变换红外进一步分析钠离子对天然石墨插层反应,如图 4(a)所示。三元石墨插层化合物(t-GIC)在负极材料为石墨,电解液为1 moL·L-1 NaPF6盐溶于二乙二醇二甲醚溶剂,对电极为钠金属的半电池体系中的形成机制如以下方程[57]所示:
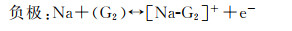
|
(1) |
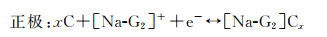
|
(2) |

|
图 4 炭质材料在醚类和酯类电解液中的SEI膜形成结构示意图及在硬碳中的典型充放电曲线 (a)钠离子基于酯基和醚基电解液对天然石墨的插层机制[54];(b)硬碳在酯基和醚基电解液中的典型充放电曲线[58];(c)在不同电解液中钠离子向SEI移动的结构示意图[59];(d)不同电解液中SEI不同成分示意图[62] Fig. 4 Schematic diagram of the SEI formation in carbon aceous materials with ether and ester electrolytes as well as the typical charge/discharge curves in HC systems (a)mechanisms of Na ion insertion into natural graphite using carbonate-based and ether-based electrolytes[54]; (b)typical charge/discharge curves of HC in ester and ether based electrolyte[58]; (c)schematic illustration of sodium ions moving into the SEI layers formed in different electrolytes[59]; (d)schematic illustration of different components of SEI in various electrolytes[62] |
其中[Na-G2]+指的是溶剂化钠离子; [Na-G2]Cx指的是t-GIC。这一过程是热力学稳定的,醚类溶剂与石墨之间的范德华力相互作用增强了层间耦合强度,石墨的层间距显著增大,这是由[Na-ether+]复合物与石墨在石墨通道中平行堆叠的构型引起的。溶剂化钠离子化合物通过形成三元石墨插层化合物(t-GIC),可以可逆地嵌入到层状结构中。
相比于石墨,由于HC是高度无序的结构所以不利于三元共插层。Xiao等[58]通过对比醚类电解液和酯类电解液在硬碳中的充放电曲线推测其没有共插层现象(图 4(b))。X射线光电子能谱(XPS)分析表明,与碳酸盐相比,醚类电解液体系中形成的SEI要薄得多。相似的结论在Bai等[59]的工作中使用Diglyme作电解质溶剂时也体现出来(图 4(c))。其中Bai等将基于酯类电解质中形成的SEI和基于醚类的电解质保护的HC阳极结合在一起,融合了基于酯和醚类的电解质的优点,实现了高的可逆容量。Zhu等[60]发现在醚基电解质中,硬碳在高倍率下的平台容量可以显著提高从而提高整体倍率性能。Hou等[61]研究的自支撑硬碳材料的工作机理分析表明,在较低的电化学反应动力学条件下,平台区是倍率提高的决定步骤,在醚基电解质中可以得到明显的改善。除了硬碳材料,高比表面的碳材料如还原氧化石墨烯(rGO)、活性炭(AC)、有序介孔炭(CMK-3)也作为储钠材料。这些大比表面结构会导致严重的界面问题,较低的首次库仑效率等问题。Zhang等[62]提出,通过使用醚类电解质,在高比表面积炭负极(rGO)上形成稳定、均匀且离子导电的SEI膜,并通过XPS测试分析了不同体系SEI膜的成分如图 4(d)所示,最终提高了首次库仑效率和倍率性能。
随后,一些其他材料如碳纳米管[63]、炭黑[64]和二氧化钛[65]等同样被应用于醚类电解液中,这些报道同样表明了与碳酸酯电解质相比,醚基电解液对SEI膜的形成更关键,同时在充放电过程中能表现出出色的动力学行为。在这些材料中,四边形碳纳米管(q-CNT)在醚类和酯类电解液中均具有良好的钠离子储存特性,其主要原因是人字形的石墨化壁和较小的石墨化层尺寸,这会削弱电解质对钠离子动力学扩散的控制作用,通过缩短扩散距离并且提供更多的扩散通道。当醚类电解液应用于兼具石墨化和无序炭结构的炭黑材料中,Xiao等[64]提出了一种醚类电解液在石墨结构中溶剂化钠共插层和无序炭结构中的钠插层结合的反应机理。具有较大比表面积的TiO2/炭电极在酯类电解液体系中生成的SEI层较厚,从而限制钠离子的扩散并降低了TiO2电极的反应动力学和循环稳定性。Li等[65]解释了在电解质和电极之间的界面上,电荷转移的能垒是决定界面电化学特性的因素,因此解释了酯基和醚基电解质在TiO2负极体系中的储能机制。
相比于溶剂对炭负极表面的影响,Seh等[66]首次报道了溶剂对钠金属阳极的影响。室温下金属钠阳极在长期电镀和剥离过程中可逆性较差,主要是由于形成了不均匀的固体电解质中间相和钠枝晶。用简单的NaPF6盐溶于醚类溶剂(glymes (mono-,di-,tetraglyme))中,可以实现高度可逆的和非树枝状的电镀。枝晶的生长导致SEI的不断断裂和重新形成,最终导致电池由于电解质的耗尽和通过厚的SEI产生的高阻抗而失效,如图 5(a)所示。一个理想的电解质应该能够在钠金属表面形成一个均匀而致密的SEI,它对电解质溶剂具有很高的抗渗性,并且在长期的电镀和剥离过程中能够抑制钠枝晶的生长,如图 5(b)所示。同时也利用不刻蚀深度XPS测试分析了在钠金属表面的SEI膜组分,SEI膜的表面由有机盐组成(RCH2ONa),深层由无机盐组成(Na2O, NaF),如图 5(c)所示。

|
图 5 不同的钠沉积形式以及钠金属表面SEI成分图[66] (a)枝晶状;(b)非枝晶状钠沉积示意图;(c)基于NaPF6在glymes体系中钠金属表面SEI形成示意图 Fig. 5 Different forms of sodium deposition and SEI composition on the surface of sodium metal[66] (a)dendritic; (b)schematic of nondendritic Na deposition; (c)schematic showing the SEI formed on the Na metal surface using NaPF6 in glymes |
从以上总结的近年来醚类电解液对钠离子电池的功能性作用包括界面的改善、倍率和首效的提升等优势来看,醚类电解液确实解决了钠电目前面临的问题,但从长远角度来看,将钠离子电池大规模应用,还需要考虑其在全电池中面临的挑战。
5 结束语钠离子电池电解质的研究主要集中在以下方面:
(1) 许多研究集中于电解液本身的物化性能如黏度、电导率等,今后应从分子动力学模拟的角度探究溶剂分子内部能量平衡,结合电极材料的特殊结构分析钠离子电池的储钠机理,更有利于选择匹配的电解液电极材料实现高容量的需求。
(2) 电解液与电极材料的兼容性也至关重要,例如常用的酯类电解液无法应用于石墨负极材料,但是醚类电解液可以使钠离子以溶剂化的形式进入层间储能。此外添加剂的选择也同样与电极材料相关。总之注重电极电解液的匹配及开发新型添加剂是实现钠离子电池高性能的关键因素。
(3) 先进的测试分析方法对于研究钠离子电池固体电解质界面的成分和结构至关重要,其主要测试方法有:SEM,TEM通常来表征SEI的厚度;AFM用来表征SEI的机械强度和粗糙度;X射线光电子能谱(XPS),X射线光电子能谱元素深度剖析(Depth XPS);固体核磁共振(SS-NMR)、傅里叶红外光谱(FTIR)、拉曼光谱(Raman)、飞行时间二次离子质谱仪(TOF-SIMS)通常来研究SEI的组分;此外蒙特卡洛模拟(MC)和分子动力学模拟(MD)的结合可以研究SEI的形成过程和内部复杂的化学反应。
(4) 电池的安全性是市场及客户关注的最重要的关键指标,常用的有机电解液无法在高温环境下正常运行,所以开发阻燃剂或者使用离子液体等具有较高热稳定性的溶剂可能是实现钠离子电池安全性的考虑范围之内。
总之,醚类和酯类电解液的开发在很大程度上推动了钠离子电池的发展,未来在电解液的选择和固体电解质界面的调控优化上,将进一步使钠离子电池向实际应用方向靠拢,使其在大规模储能方向得到广泛应用。
| [1] |
CHEN H, CONG T N, YANG W, et al. Progress in electrical energy storage system: a critical review[J]. Progress in Natural Science, 2009, 19(3): 291-312. DOI:10.1016/j.pnsc.2008.07.014 |
| [2] |
BRADBURY K, PRATSON L, PATIÑO-ECHEVERRI D. Economic viability of energy storage systems based on price arbitrage potential in real-time U.S. electricity markets[J]. Applied Energy, 2014, 114: 512-519. DOI:10.1016/j.apenergy.2013.10.010 |
| [3] |
STERNBERG A, BARDOW A. Power-to-what?-environmental assessment of energy storage systems[J]. Energy & Environmental Science, 2015, 8(2): 389-400. |
| [4] |
THACKERAY M M, WOLVERTON C, ISAACS E D. Electrical energy storage for transportation—approaching the limits of, and going beyond, lithium-ion batteries[J]. Energy & Environmental Science, 2012, 5(7): 7854-7863. |
| [5] |
TARASCON J M. Is lithium the new gold?[J]. Nat Chem, 2010, 2(6): 510. DOI:10.1038/nchem.680 |
| [6] |
王凡凡, 刘晓斌, 陈龙, 等. 室温钠离子电池关键材料研究进展[J]. 电化学, 2019, 25(1): 58-79. WANG F F, LIU X B, CHEN L, et al. Research progress on key materials of room temperature sodium ion batteries[J]. Journal of Electrochemistry, 2019, 25(1): 58-79. |
| [7] |
PALOMARES V, SERRAS P, VILLALUENGA I, et al. Na-ion batteries, recent advances and present challenges to become low cost energy storage systems[J]. Energy & Environmental Science, 2012, 5(3): 5884-5901. |
| [8] |
KIM S W, SEO D H, MA X, et al. Electrode materials for rechargeable sodium-ion batteries: potential alternatives to current lithium-ion batteries[J]. Advanced Energy Materials, 2012, 2(7): 710-721. DOI:10.1002/aenm.201200026 |
| [9] |
LIN Z, XIA Q, WANG W, et al. Recent research progresses in ether-and ester-based electrolytes for sodium-ion batteries[J]. InfoMat, 2019, 1(3): 376-389. DOI:10.1002/inf2.12023 |
| [10] |
CHE H, CHEN S, XIE Y, et al. Electrolyte design strategies and research progress for room-temperature sodium-ion batteries[J]. Energy & Environmental Science, 2017, 10(5): 1075-1101. |
| [11] |
XU K. Electrolytes and interphases in Li-ion batteries and beyond[J]. Chem Rev, 2014, 114(23): 11503-11618. DOI:10.1021/cr500003w |
| [12] |
BOMMIER C, JI X. Electrolytes, SEI formation, and binders: a review of nonelectrode factors for sodium-ion battery anodes[J]. Small, 2018, 14(16): e1703576. DOI:10.1002/smll.201703576 |
| [13] |
HAYASHI A, NOI K, SAKUDA A, et al. Superionic glass-ceramic electrolytes for room-temperature rechargeable sodium batteries[J]. Nat Commun, 2012, 3(5): 856. |
| [14] |
WANG Q, JIANG L, YU Y, et al. Progress of enhancing the safety of lithium ion battery from the electrolyte aspect[J]. Nano Energy, 2019, 55: 93-114. DOI:10.1016/j.nanoen.2018.10.035 |
| [15] |
LEVCHIK S V, WEIL E D. A review of recent progress in phosphorus-based flame retardants[J]. Journal of Fire Sciences, 2006, 24(5): 345-364. DOI:10.1177/0734904106068426 |
| [16] |
JACHE B, ADELHELM P. Use of graphite as a highly reversible electrode with superior cycle life for sodium-ion batteries by making use of co-intercalation phenomena[J]. Angewandte Chemie International Edition, 2014, 53(38): 10169-10173. DOI:10.1002/anie.201403734 |
| [17] |
LU Y, LI L, ZHANG Q, et al. Electrolyte and interface engineering for solid-state sodium batteries[J]. Joule, 2018, 2(9): 1747-1770. DOI:10.1016/j.joule.2018.07.028 |
| [18] |
PONROUCHA A, MONTIA D, BOSCHIN A, et al. Non-aqueous electrolytes for sodium-ion batteries[J]. Journal of Materials Chemistry A, 2015, 3: 22-42. DOI:10.1039/C4TA04428B |
| [19] |
TAKADA K, YAMADA Y, WATANABE E, et al. Unusual passivation ability of superconcentrated electrolytes toward hard carbon negative electrodes in sodium-ion batteries[J]. ACS Appl Mater Interfaces, 2017, 9(39): 33802-33809. DOI:10.1021/acsami.7b08414 |
| [20] |
DONG X, CHEN L, LIU J, et al. Environmentally-friendly aqueous Li (or Na) -ion battery with fast electrode kinetics and super-long life[J]. Science Advances, 2016, 2(1): e1501038. DOI:10.1126/sciadv.1501038 |
| [21] |
DONG X, CHEN L, SU X, et al. Flexible aqueous lithium-ion battery with high safety and large volumetric energy density[J]. Angewandte Chemie International Edition, 2016, 55(26): 7474-7477. DOI:10.1002/anie.201602766 |
| [22] |
朱墨书棋, 林春香, 骆微, 等. 离子液体中纤维素/TiO2复合材料的制备及其性能[J]. 材料工程, 2016, 44(12): 67-73. ZHUMO S Q, LIN C X, LUO W, et al. Ionic liquid-assisted synthesis of cellulose/TiO2 composite and photocatalytic performance[J]. Journal of Materials Engineering, 2016, 44(12): 67-73. |
| [23] |
孙健, 李岱霖, 倪菲, 等. 离子液体应用的研究进展[J]. 应用化工, 2019, 48(7): 1724-1733. SUN J, LI D L, NI F, et al. Advances in the applications of ionic liquids[J]. Applied Chemical Industry, 2019, 48(7): 1724-1733. DOI:10.3969/j.issn.1671-3206.2019.07.049 |
| [24] |
HUANG Y, ZHAO L, LI L, et al. Electrolytes and electrolyte/electrode interfaces in sodium-ion batteries: from scientific research to practical application[J]. Advanced Materials, 2019, 31(21): 1808393. DOI:10.1002/adma.201808393 |
| [25] |
YANG Q, ZHANG Z, SUN X G, et al. Ionic liquids and derived materials for lithium and sodium batteries[J]. Chem Soc Rev, 2018, 47(6): 2020-2064. DOI:10.1039/C7CS00464H |
| [26] |
KIM J I, CHOI Y, CHUNG K Y, et al. A structurable gel-polymer electrolyte for sodium ion batteries[J]. Advanced Functional Materials, 2017, 27(34): 1701768. DOI:10.1002/adfm.201701768 |
| [27] |
CHEN G, ZHANG F, ZHOU Z, et al. A flexible dual-ion battery based on PVDF-HFP-modified gel polymer electrolyte with excellent cycling performance and superior rate capability[J]. Advanced Energy Materials, 2018, 8(25): 1801219. DOI:10.1002/aenm.201801219 |
| [28] |
GAO H, ZHOU W, PARK K, et al. A sodium-ion battery with a low-cost cross-linked gel-polymer electrolyte[J]. Advanced Energy Materials, 2016, 6(18): 1600467. DOI:10.1002/aenm.201600467 |
| [29] |
LIM D H, AGOSTINI M, AHN J H, et al. An electrospun nanofiber membrane as gel-based electrolyte for room-temperature sodium-sulfur batteries[J]. Energy Technology, 2018, 6(7): 1214-1219. DOI:10.1002/ente.201800170 |
| [30] |
ZHANG Z, ZHANG Q, REN C, et al. A ceramic/polymer composite solid electrolyte for sodium batteries[J]. Journal of Materials Chemistry A, 2016, 4(41): 15823-15828. DOI:10.1039/C6TA07590H |
| [31] |
付雪连, 李玉超, 战艳虎, 等. 全固态钠离子电池用聚氧化乙烯基固态聚合物电解质研究进展[J]. 高分子材料科学与工程, 2019, 35(9): 177-184. FU X L, LI Y C, ZHAN Y H, et al. Progress of polyethylene oxide-based solid polymer electrolytes for all solid-state sodium-ion battery[J]. Polymer Materials Science and Engineering, 2019, 35(9): 177-184. |
| [32] |
KIM J J, YOON K, PARK I, et al. Progress in the development of sodium-ion solid electrolytes[J]. Small, 2017, 1(10): 1700219. DOI:10.1002/smtd.201700219 |
| [33] |
PLEWA-MARCZEWSKA A, TRZECIAK T, BITNER A, et al. New tailored sodium salts for battery applications[J]. Chemistry of Materials, 2014, 26(17): 4908-4914. DOI:10.1021/cm403349t |
| [34] |
CHEN S, ISHⅡ J, HORIUCHI S, et al. Difference in chemical bonding between lithium and sodium salts: influence of covalency on their solubility[J]. Phys Chem Chem Phys, 2017, 19(26): 17366-17372. DOI:10.1039/C7CP03009F |
| [35] |
XU K. Nonaqueous liquid electrolytes for lithium-based rechargeable batteries[J]. Chem Rev, 2004, 104(10): 4303-4417. DOI:10.1021/cr030203g |
| [36] |
PONROUCH A, MARCHANTE E, COURTY M, et al. In search of an optimized electrolyte for Na-ion batteries[J]. Energy & Environmental Science, 2012, 5(9): 8572-8583. |
| [37] |
STEVENS D A, DAHNA J R. High capacity anode materials for rechargeable sodium-ion batteries[J]. Electrochem Soc, 2000, 4(147): 1271-1273. |
| [38] |
RICARDO A, PEDRO L, GREGORIO F O, et al. Carbon microspheres obtained from resorcinol-formaldehyde as high-capacity electrodes for sodium-ion batteries[J]. Electrochemical and Solid-State Letters, 2005, 8(4): A222-A225. DOI:10.1149/1.1870612 |
| [39] |
KOMABA S, MURATA W, ISHIKAWA T, et al. Electrochemical Na insertion and solid electrolyte interphase for hard-carbon electrodes and application to Na-ion batteries[J]. Advanced Functional Materials, 2011, 21: 3859-3867. DOI:10.1002/adfm.201100854 |
| [40] |
ESHETU G G, GRUGEON S, KIM H, et al. Comprehensive insights into the reactivity of electrolytes based on sodium ions[J]. Chem Sus Chem, 2016, 9(5): 462-471. DOI:10.1002/cssc.201501605 |
| [41] |
ZHU Y, LUO X, ZHI H, et al. Diethyl(thiophen-2-ylmethyl)phosphonate: a novel multifunctional electrolyte additive for high voltage batteries[J]. Journal of Materials Chemistry A, 2018, 6(23): 10990-11004. DOI:10.1039/C8TA01236A |
| [42] |
ESHETU G G, GRUGEON S, GACHOT G, et al. LiFSI vs LiPF6 electrolytes in contact with lithiated graphite: comparing thermal stabilities and identification of specific SEI-reinforcing additives[J]. Electrochimica Acta, 2013, 102: 133-141. DOI:10.1016/j.electacta.2013.03.171 |
| [43] |
ESHETU G G, DIEMANT T, HEKMATFAR M, et al. Impact of the electrolyte salt anion on the solid electrolyte interphase formation in sodium ion batteries[J]. Nano Energy, 2019, 55: 327-340. DOI:10.1016/j.nanoen.2018.10.040 |
| [44] |
YABUUCHI N, KUBOTA K, DAHBI M, et al. Research development on sodium-ion batteries[J]. Chem Rev, 2014, 114(23): 11636-11682. DOI:10.1021/cr500192f |
| [45] |
SOTO F A, YAN P, ENGELHARD M H, et al. Tuning the solid electrolyte interphase for selective Li- and Na-ion storage in hard carbon[J]. Advanced Materials, 2017, 29(18): 1606860. DOI:10.1002/adma.201606860 |
| [46] |
SHAKOURIAN-FARD M, KAMATH G, SMITH K, et al. Trends in Na-ion solvation with alkyl-carbonate electrolytes for sodium-ion batteries: insights from first-principles calculations[J]. The Journal of Physical Chemistry C, 2015, 119(40): 22747-22759. DOI:10.1021/acs.jpcc.5b04706 |
| [47] |
XING L, ZHENG X, SCHROEDER M, et al. Deciphering the ethylene carbonate-propylene carbonate mystery in Li-ion batteries[J]. Accounts of Chemical Research, 2018, 51(2): 282-289. DOI:10.1021/acs.accounts.7b00474 |
| [48] |
KAMATH G, CUTLER R W, DESHMUKH S A, et al. In silico based rank-order determination and experiments on nonaqueous electrolytes for sodium ion battery applications[J]. The Journal of Physical Chemistry C, 2014, 118(25): 13406-13416. DOI:10.1021/jp502319p |
| [49] |
LEE M, HONG J, LOPEZ J, et al. High-performance sodium-organic battery by realizing four-sodium storage in disodium rhodizonate[J]. Nature Energy, 2017, 2(11): 861-868. DOI:10.1038/s41560-017-0014-y |
| [50] |
SONG J, XIAO B, LIN Y, et al. Interphases in sodium-ion batteries[J]. Advanced Energy Materials, 2018, 8(17): 1703082. DOI:10.1002/aenm.201703082 |
| [51] |
ALVARADO J, SCHROEDER M A, POLLARD T P, et al. Bisalt ether electrolytes: a pathway towards lithium metal batteries with Ni-rich cathodes[J]. Energy & Environmental Science, 2019, 12(2): 780-794. |
| [52] |
MIAO R, YANG J, XU Z, et al. A new ether-based electrolyte for dendrite-free lithium-metal based rechargeable batteries[J]. Sci Rep, 2016, 6: 21771. DOI:10.1038/srep21771 |
| [53] |
XU G L, AMINE R, ABOUIMRANE A, et al. Challenges in developing electrodes, electrolytes, and diagnostics tools to understand and advance sodium-ion batteries[J]. Advanced Energy Materials, 2018, 8(14): 1702403. |
| [54] |
KIM H, HONG J, PARK Y U, et al. Sodium storage behavior in natural graphite using ether-based electrolyte systems[J]. Advanced Functional Materials, 2015, 25(4): 534-541. DOI:10.1002/adfm.201402984 |
| [55] |
JACHE B, BINDER J O, ABE T, et al. A comparative study on the impact of different glymes and their derivatives as electrolyte solvents for graphite co-intercalation electrodes in lithium-ion and sodium-ion batteries[J]. Physical Chemistry Chemical Physics, 2016, 18(21): 14299-14316. DOI:10.1039/C6CP00651E |
| [56] |
HONG S Y, KIM Y, PARK Y, et al. Charge carriers in rechargeable batteries: Na ions vs Li ions[J]. Energy & Environmental Science, 2013, 6(7): 2067-2081. |
| [57] |
XU Z L, YOON G, PARK K Y, et al. Tailoring sodium intercalation in graphite for high energy and power sodium ion batteries[J]. Nature Communications, 2019, 10(1): 2598. DOI:10.1038/s41467-019-10551-z |
| [58] |
XIAO B W, SOTO F A, GU M, et al. Lithium-pretreated hard carbon as high-performance sodium-ion battery anodes[J]. Advanced Energy Materials, 2018, 8(24): 1801441. DOI:10.1002/aenm.201801441 |
| [59] |
BAI P, HE Y, XIONG P, et al. Long cycle life and high rate sodium-ion chemistry for hard carbon anodes[J]. Energy Storage Materials, 2018, 13: 274-282. DOI:10.1016/j.ensm.2018.02.002 |
| [60] |
ZHU Y E, YANG L, ZHOU X, et al. Boosting the rate capability of hard carbon with an ether-based electrolyte for sodium ion batteries[J]. Journal of Materials Chemistry A, 2017, 5(20): 9528-9532. DOI:10.1039/C7TA02515G |
| [61] |
HOU B H, WANG Y Y, NING Q L, et al. Self-supporting, flexible, additive-free, and scalable hard carbon paper self-interwoven by 1D microbelts: superb room/low-temperature sodium storage and working mechanism[J]. Advanced Materials, 2019, 31(40): e1903125. DOI:10.1002/adma.201903125 |
| [62] |
ZHANG J, WANG D W, LV W, et al. Achieving superb sodium storage performance on carbon anodes through an ether-derived solid electrolyte interphase[J]. Energy & Environmental Science, 2017, 10(1): 370-376. |
| [63] |
YANG B, LIU S, GUO X, et al. Na-ion storage behaviors of quadrangular herringbone-carbon nanotubes in ether-and ester-based electrolyte systems[J]. ACS Sustainable Chemistry & Engineering, 2018, 6(12): 17184-17193. |
| [64] |
XIAO W, SUN Q, LIU J, et al. Utilizing the full capacity of carbon black as anode for Na-ion batteries via solvent co-intercalation[J]. Nano Research, 2017, 10(12): 4378-4387. |
| [65] |
LI K, ZHANG J, LIN D, et al. Evolution of the electrochemical interface in sodium ion batteries with ether electrolytes[J]. Nat Commun, 2019, 10(1): 725. |
| [66] |
SEH Z W, SUN J, SUN Y, et al. A highly reversible room-temperature sodium metal anode[J]. ACS Cent Sci, 2015, 1(8): 449-455. |
 2021, Vol. 49
2021, Vol. 49


