文章信息
- 余宛键, 耿鹏, 文玫, 陈志钢
- YU Wan-jian, GENG Peng, WEN Mei, CHEN Zhi-gang
- 明胶辅助共沉淀法合成硫化铜纳米材料及其光热消融癌细胞
- Gelatin-mediated coprecipitation synthesis of copper sulfide nanoparticles for photothermal ablation of cancer cells
- 材料工程, 2020, 48(12): 68-74
- Journal of Materials Engineering, 2020, 48(12): 68-74.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2019.001037
-
文章历史
- 收稿日期: 2019-11-13
- 修订日期: 2020-04-15
癌症严重威胁人们的健康和社会的发展[1]。传统的癌症治疗方法主要有手术切除、化学药物治疗和放射治疗。这些治疗方法取得了很多进展,但仍存在一些不足,比如副作用大、治疗后易复发和转移等。为了解决以上问题,近年来人们开发了多种基于纳米材料的新型癌症治疗技术。其中近红外(NIR)激光诱导的光热疗法(PTT)具有微创、高效等优点,引起了人们的广泛关注[2]。光热治疗技术利用光热试剂将NIR激光转换为热能,在肿瘤部位形成局部高温来杀死癌细胞,其技术核心是发展光热转换效率高、生物相容性好、具有靶向功能的光热材料[3-4]。迄今为止,人们已经研究了多种光热纳米试剂,主要分为四类:第一类是有机聚合物[5],这一类材料具有生物相容性较好、可降解等优点,但其抗光漂白能力较差、易团聚。第二类是碳基光热纳米材料[6],其性能稳定,但是对近红外光的吸收能力低。第三类是贵金属基光热纳米材料[7],这些材料光热转换性能好、吸收峰可调,但是价格昂贵、稳定性一般。最后一类是半导体基光热纳米材料[8],如铜基[9]、钨基半导体[10]。半导体基光热纳米材料具有成本低廉、NIR光吸收可调和光热转换效率高等优点,吸引了研究者的广泛关注[8]。其中硫化铜(CuS)是最早研究的半导体光热试剂[11]。早在2010年,陈伟教授团队就制备了CuS纳米颗粒[12],该材料具有强的近红外吸收能力,在功率密度为24 W/cm2的808 nm激光照射下,展现出良好的光热转化性能,但是因激光功率较高,会对生物体产生副作用。为了提高CuS的光热效果和降低激光功率,通过水热法合成CuS花状超结构,该溶液在功率为0.51 W/cm2的980 nm激光照射下,可以有效消融癌细胞。随后,研究者们通过各种合成策略制备不同的CuS光热试剂,包括水热合成[13]、共沉淀[14]、热分解法[15]等。目前,多种不同形貌的CuS纳米材料和CuS纳米复合材料已经被开发。为了进一步调控CuS的形貌、尺寸和表面性质,可加入一些有机分子或者聚合物作为表面配体,例如聚乙烯吡咯烷酮[16]、巯基乙酸[12]等。但是,它们也有许多固有的局限性,例如其靶向积累能力[13]、光热转换能力和稳定性[12]等还不理想,有些高分子配体也有一定毒性[13]。
众所周知,相比人工合成的有机分子或聚合物,天然生物分子具有更好的生物相容性[17]。利用天然生物分子作为表面配体来制备或包裹无机光热纳米材料,具有生物相容性好和环境友好等优点[18]。目前,一些生物分子已用于碳材料、贵金属基和半导体基纳米材料的合成和表面改性[19]。然而,CuS光热转换材料依旧存在尺寸需要调控、光热转换效率和生物毒性还不理想等问题。
明胶(Gelatin)是胶原蛋白经部分水解后产生的多种氨基酸缩聚所得的产物,具有较高的反应活性、低毒性、生物相容性,含有丰富的羟基(—OH)和氨基(—NH2)官能团[20-21],这些化学官能团能螯合金属离子。因此,本研究选用明胶为配体采用共沉淀法合成了CuS-gelatin纳米材料。分析了不同明胶用量、反应温度、时间等对CuS纳米材料形貌、晶相、光吸收等的影响,遴选出性能最佳的CuS-gelatin纳米材料用于癌细胞的高效光热治疗。
1 实验材料与方法 1.1 实验原料二水合氯化铜(CuCl2·2H2O,分析纯)、九水合硫化钠(Na2S·9H2O,分析纯)、明胶(分析纯)、盐酸(分析纯)、氨水(NH3·H2O,分析纯)。磷酸盐缓冲溶液(PBS)、钙黄绿素-AM (Calcein-AM)、碘化丙啶(PI)和CCK-8试剂盒。
1.2 CuS-gelatin的合成分别将0,0.25,0.5,0.75 g明胶和0.170 g的CuCl2·2H2O溶解在30 mL水溶液中,在70 ℃条件下磁力搅拌30 min。然后将5 mL浓度为97.6 mg/mL的Na2S溶液缓慢滴入上述溶液,搅拌10 min后加入NH3·H2O调节pH值至7.0,继续在70 ℃条件下反应6 h。反应结束后,10000 r/min下离心5 min,再使用蒸馏水洗涤、离心3次去除杂质,最后获得墨绿色沉淀物。确定最佳明胶用量后,分别在60,70,80 ℃条件下反应6 h,或在70 ℃里分别反应12,24 h。将部分CuS冷冻干燥用于表征,部分分散在水中便于后续实验。
1.3 样品表征使用JEM-2100F型透射电子显微镜来表征样品形貌和尺寸。通过Bruker D4 X型X射线衍射仪测试样品的晶体结构。使用Lambda 950型UV-vis-NIR分光光度计测量UV-vis-NIR吸收光谱。通过IR Prestige-21光谱仪测试傅里叶变换红外光谱。
在光热性能测试实验中,使用功率为1.0 W/cm2的1064 nm半导体激光器分别照射离心管中的CuS-gelatin、纯CuS-样品溶液,对照组为纯水,并使用FLIR A300热成像仪实时测量并记录分散液的温度变化。
1.4 细胞毒性测定4T1细胞、HUVEC细胞购买于中国科学院细胞库。将4T1细胞接种在96孔板中,并在37 ℃,5% (质量分数,下同)CO2的标准条件下孵育24 h。然后将孔板中的培养基吸出,每孔再分别加入100 μL一系列梯度浓度的纯CuS或CuS-gelatin样品的新鲜培养基。孵育24 h后洗去材料,用PBS洗涤细胞,再加入100 μL含有10% CCK-8的新鲜培养基,并孵育2 h。最后通过酶标仪测定细胞活力,所有细胞毒性过程均独立进行5次。纳米材料和HUVEC细胞培养与毒性测试同上。
1.5 体外细胞的光热消融将4T1细胞接种在24孔板中,并在37 ℃,5% CO2标准条件下孵育。24 h后,用含有浓度为0.40 mg/mL的CuS-gelatin材料培养基替换旧培养基,进一步孵育30 min。然后,将样品置于1064 nm激光器下,分别以0,0.5,0.75,1.0 W/cm2激光功率照射10 min;或以1.0 W/cm2激光功率分别照射0,2,4,6,8,10 min。用PBS洗涤细胞后每个孔中加入200 μL Calcein-AM和PI染色液,30 min后将染色液吸出并通过共聚焦荧光显微镜成像观察。
2 结果与讨论 2.1 明胶用量对CuS形貌的影响明胶辅助共沉淀法制备CuS-gelatin纳米材料的典型过程如图 1所示。明胶含有大量的羟基(—OH)和氨基(—NH2)官能团,这些官能团能螯合金属离子。当CuCl2水溶液加入明胶水溶液时,明胶会化学吸附Cu2+,形成蓝色溶液。加入Na2S水溶液后,吸附在明胶中的Cu2+将与S2-反应,生成CuS晶核并长大,随后溶液变成墨绿色。同时,明胶会配位在原位生长的CuS纳米颗粒表面。
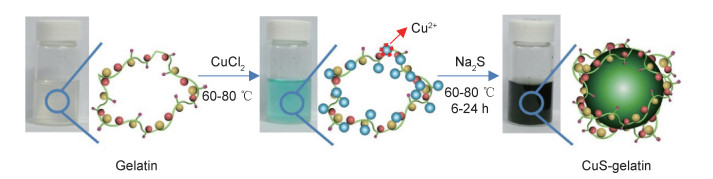
|
图 1 CuS-gelatin纳米材料的典型制备过程 Fig. 1 Typical preparation process of CuS-gelatin nanoparticles |
图 2为加入明胶0,0.25,0.5,0.75 g于70 ℃反应6 h制备的CuS样品的TEM图。从图 2可以看出,未添加明胶时,得到平均粒径小于10 nm的CuS纳米颗粒,颗粒存在明显的团聚现象。当明胶添加量为0.25~0.50 g时,CuS样品分散均匀,尺寸约为10~15 nm。当明胶添加量为0.75 g时,产物为500 nm×500 nm左右的方块状,且有大量未反应的絮状明胶,可能是过量的明胶使反应不均匀。因此,最佳明胶用量为0.25~0.5 g。

|
图 2 加入明胶0 g (a),0.25 g (b),0.5 g (c),0.75 g (d)于70 ℃反应6 h制备的CuS样品TEM图 Fig. 2 TEM images of CuS samples prepared by using gelatin 0 g (a), 0.25 g (b), 0.5 g (c), 0.75 g (d) at 70 ℃ for 6 h |
图 3为使用0.5 g明胶在60,70,80 ℃下反应6 h所得产品的TEM图。温度为60 ℃时,CuS样品为2 nm左右的量子点(见图 3(a))。高分辨透射电镜表明该样品有晶格,晶面间距为0.19 nm,对应于六方相CuS的(110)晶面;但晶面比较模糊,说明结晶度较低。当温度为70 ℃时,所得产物的平均粒径增加到≈5 nm,其晶格条纹变得明显,晶格间距为0.19 nm(见图 3(b)),表明结晶度提高。进一步升温到80 ℃时,所得的产物的平均尺寸增大到5~10 nm,在图 3(c)中可看到清晰的晶格,其间距为0.19 nm。因此,随着反应温度的增加,CuS纳米颗粒的尺寸逐渐增加且结晶度有所提高。

|
图 3 60 ℃ (a),70 ℃ (b),80 ℃ (c)反应6 h的CuS样品TEM图 Fig. 3 TEM images of CuS samples reacted at 60 ℃ (a), 70 ℃ (b), 80 ℃ (c) for 6 h |
图 4为使用0.5 g明胶在70 ℃下反应6,12,24 h所得产品的TEM图。由图 4可见,反应6 h后,产物为直径5~10 nm的量子点。将时间延长到12 h,产物粒径增大到约10 nm,具有明显的晶格条纹。当时间延长到24 h时,产物为超薄的CuS纳米片,该纳米片没有明显的边缘结构,其直径超过200 nm,且具有明显的晶格,晶格间距为0.19 nm,对应六方相CuS的(110)晶面。

|
图 4 70 ℃下反应6 h (a),12 h (b),24 h (c) CuS样品TEM图 Fig. 4 TEM images of CuS samples reacted at 70 ℃ for 6 h (a), 12 h (b), 24 h (c) |
图 5为不同条件下制备的CuS-gelatin样品的XRD图谱。由图 5可见,所有样品在29.30°,31.80°,32.87°,47.98°,52.72°和59.36°处均出现衍射峰,这些衍射峰分别对应于六方相CuS晶体的(102),(103),(006),(110),(108)和(116)晶面(JCPDS No.06-0464),说明这些样品均为六方相CuS。反应时间相同时,随着反应温度的升高,样品的衍射峰强度增加;反应温度相同时,随着反应时间延长衍射峰强度也增加。这说明增加反应温度或时间会提高CuS样品的结晶度。

|
图 5 不同条件下合成CuS-gelatin样品的XRD图谱 Fig. 5 XRD patterns of CuS-gelatin samples prepared at different conditions |
图 6为以80 ℃,6 h条件制备的CuS-gelatin样品为代表的FTIR光谱。从图 6可以看出,约3440 cm-1处显示出宽吸收带,来自O—H伸缩振动[21],1640 cm-1处的峰来自C=O的伸缩振动,1532 cm-1的吸收峰来自N—H的弯曲振动,1450 cm-1处的峰来自CH2弯曲振动,1100 cm-1处的峰来自C—O的伸缩振动,这几个峰与纯明胶的峰基本吻合[22]。因此,以上结果说明CuS纳米材料表面有明胶配体。
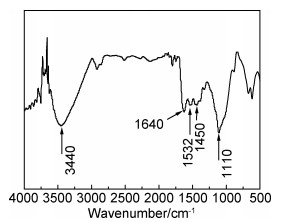
|
图 6 CuS-gelatin材料的FTIR图谱 Fig. 6 FTIR spectrum of CuS-gelatin sample |
图 7为不同CuS-gelatin样品溶液的UV-vis-NIR光谱,并将所得数据做归一化处理,由图 7可见,不同条件下所得的CuS-gelatin溶液都显示出类似的吸收带,在波长为620 nm处出现最小吸收峰;随着波长的增加吸收强度开始逐渐增强,并在1064 nm左右出现最大吸收峰,表明材料对波长为1064 nm的激光有较高的光热转换性能。另外,反应温度为80 ℃、时间为6 h条件下的产物在1000 nm左右有最高的光吸收,表明其光吸收性能最好。
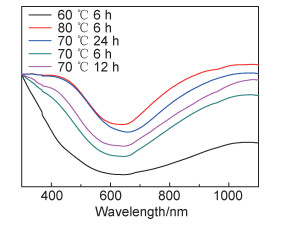
|
图 7 不同条件下合成CuS-gelatin样品的UV-vis-NIR吸收光谱 Fig. 7 UV-vis-NIR absorption spectra of CuS-gelatin samples at different conditions |
由于80 ℃反应6 h制备的CuS-gelatin样品具有最强的NIR光吸收,本研究测试了该样品的光热转换能力。采用1064 nm激光分别照射浓度为0.4 mg/mL的CuS-gelatin和纯CuS样品溶液,纯水为对照组,300 s后关闭激光;期间利用热成像仪记录了温度变化,结果如图 8(a)所示。激光照射时,300 s内纯水由起始温度26.9 ℃缓慢增加到30.0 ℃,温度变化仅为3.1 ℃,表明纯水光热转换能力较弱。同样条件下,CuS-gelatin样品溶液表现出迅速升温,50 s内温度从27.0 ℃快速升高到50.0 ℃,250 s时达到57.0 ℃并趋向于稳定,300 s时温度变化达到30.8 ℃。

|
图 8 1064 nm激光开/关状态下CuS-gelatin、纯CuS、纯水的温度曲线(a)和线性时间数据vs-lnθ的直线拟合(b) Fig. 8 Temperature curves (a) and straight linear fitting (b) of linear time data vs-lnθ of CuS-gelatin, pure CuS and pure water at 1064 nm laser on/off conditions |
随后,通过公式(1)计算CuS-gelatin纳米材料的光热转换效率η[23]:

|
(1) |
式中:Tmax为CuS-gelatin溶液300 s内达到的最高温度;Tsurr为环境温度;QDis为纯水在同等条件下吸收的热量;A1064为吸光度,应与分散体的照射深度相匹配,约为0.5;P是激光功率;为0.25 W;h和S分别为传热系数和容器的表面积,可通过公式(2)计算hS的数值:

|
(2) |
式中:mD为分散剂质量;CD为其比热容;τs为图 8(b)中斜率,为98.15,将其代入公式(2)得到hS,再将hS的数值代入公式(1),得到η。最终,CuS-gelatin样品的光热转换效率为35.7%,接近于未包覆明胶的硫化铜的38.0%。这表明明胶配体对其光热性能没有明显影响。
2.7 CuS-gelatin的细胞毒性和体外细胞消融性能图 9为细胞毒性存活率图。将4T1细胞分别与浓度为0~0.6 mg/mL的CuS-gelatin或纯CuS分散液一起孵育24 h,然后使用CCK-8测试细胞毒性。当纯CuS分散液用于孵育时,随着浓度增加,细胞存活率逐渐下降;其中浓度为0.6 mg/mL CuS孵化后细胞存活率仅为63%,表明CuS材料具有一定细胞毒性。当CuS-gelatin溶液用于孵育细胞时,在0~0.4 mg/mL浓度范围内,细胞存活率没有明显变化,当浓度增加到0.6 mg/mL,细胞存活率仅下降到85%,明显高于纯CuS的63%。另外,使用人脐静脉内皮细胞(HUVEC)对CuS-gelatin和纯CuS进行毒性测试。当浓度增加到0.6 mg/mL,CuS-gelatin溶液孵育的细胞存活率约为86%比纯CuS孵育下的70%高,与4T1存活率相似。以上结果表明,引入明胶配体后,明显降低了CuS纳米材料的细胞毒性,归因于明胶作为生物大分子配体具有理想的生物兼容性。
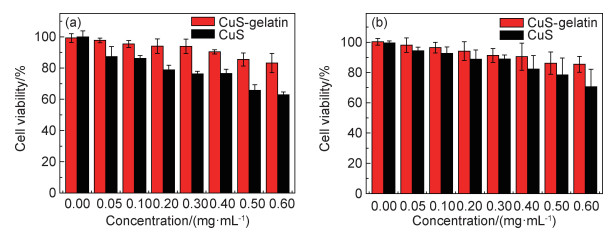
|
图 9 CuS-gelatin与纯CuS的细胞毒性 (a)4T1细胞;(b)HUVEC细胞 Fig. 9 Cytotoxicity of CuS-gelatin and pure CuS (a)4T1 cell; (b)HUVEC cell |
图 10为细胞荧光照片图。以CuS-gelatin纳米材料为光热试剂,测试了体外癌细胞的光热消融效果。将4T1细胞与浓度为0.4 mg/mL的CuS-gelatin分散液共同孵育30 min,用0~1.0 W/cm2功率的1064 nm激光照射10 min,之后用Calcein-AM和PI染色细胞。没有激光照射时,荧光图像显示为绿色,未发现细胞死亡。随着激光强度增加,图像中绿色荧光逐渐减少,红色荧光逐渐增多。当激光强度增加到0.75 W/cm2时,仅仅发现少量绿色活细胞,绝大部分细胞变为红色。特别是激光强度达到1.0 W/cm2时,染色区域在荧光显微镜下均表现为红色,表明几乎所有的4T1细胞都已经死亡。以上结果表明,增加激光强度可明显提高细胞死亡率。此外,将相同条件下与材料培养好的细胞,置于1.0 W/cm2功率的1064 nm激光下分别照射0~10 min。很明显,随着辐射时间的增加,细胞存活率下降显著。当照射时间延长至8 min,荧光图像中死细胞占据了绝大多数。继续增加照射时间至10 min,荧光图像中几乎没有活细胞,表明延长照射时间也会提高细胞死亡率。以上结果表明,在近红外光激发下CuS-gelatin纳米材料表现出优异的光热性能,能够快速消融癌细胞;通过调节激光强度和照射时间可优化癌细胞消融效果。
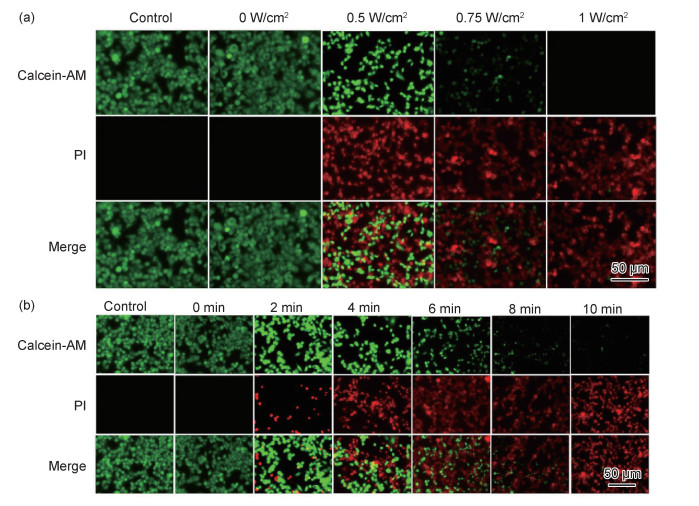
|
图 10 细胞荧光成像 (a)0~1 W/cm2,1064 nm激光照射10 min;(b)1.0 W/cm2,1064 nm激光照射0~10 min Fig. 10 Fluorescence images of cells (a)irradiated with 1064 nm laser at 0-1 W/cm2 for 10 min; (b)irradiated with 1064 nm laser at 1 W/cm2 for 0-10 min |
(1) 使用明胶为配体,通过共沉淀法制备CuS纳米材料,提高温度或增加时间会增大CuS样品的尺寸和提高结晶度。其中,80 ℃反应6 h制备的CuS-gelatin样品尺寸为5~10 nm有最强的NIR光吸收。
(2) 使用功率为1.0 W/cm2的1064 nm激光照10 min后,CuS-gelatin材料溶液具有优异的光热转换性能,光热转换效率达到35.7%。
(3) 引入明胶配体明显降低CuS纳米材料的细胞毒性。功率为1.0 W/cm2的1064 nm激光照射10 min,CuS-gelatin纳米材料几乎能够消融全部癌细胞。
| [1] |
BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018:globocan estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. Cancer Journal for Clinicians, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [2] |
刘珈, 武明花. 光热纳米材料在肿瘤治疗中的研究进展及生物反应性降解机制[J]. 生命科学仪器, 2018, 16(增刊1): 92-97. LIU J, WU M H. Research progress of photothermal nanomaterials and bioreaction degradation mechanism in cancer therapy[J]. Life Science Instruments, 2018, 16(Suppl 1): 92-97. |
| [3] |
LI Z, CHEN Y, YANG Y, et al. Recent advances in nanomaterials-based chemo-photothermal combination therapy for improving cancer treatment[J]. Front Bioeng Biotechnol, 2019, 7: 293-310. DOI:10.3389/fbioe.2019.00293 |
| [4] |
LIU S W, WANG L, LIN M, et al. Tumor photothermal therapy employing photothermal inorganic nanoparticles/polymers nanocomposites[J]. Chinese Journal of Polymer Science, 2018, 37(2): 115-128. |
| [5] |
OU H, LI J, CHEN C, et al. Organic/polymer photothermal nanoagents for photoacoustic imaging and photothermal therapy in vivo[J]. Science China Materials, 2019, 62(11): 1740-1758. DOI:10.1007/s40843-019-9470-3 |
| [6] |
ORECCHIONI M, CABIZZA R, BIANCO A, et al. Graphene as cancer theranostic tool:progress and future challenges[J]. Theranostics, 2015, 5(7): 710-723. DOI:10.7150/thno.11387 |
| [7] |
XU Y, WANG X, CHENG L, et al. High-yield synthesis of gold bipyramids for in vivo CT imaging and photothermal cancer therapy with enhanced thermal stability[J]. Chemical Engineering Journal, 2019, 378: 122025. DOI:10.1016/j.cej.2019.122025 |
| [8] |
LI J, RAO J, PU K. Recent progress on semiconducting polymer nanoparticles for molecular imaging and cancer phototherapy[J]. Biomaterials, 2018, 155: 217-235. DOI:10.1016/j.biomaterials.2017.11.025 |
| [9] |
ZHAO Y, CAI Q, QI W, et al. BSA-CuS nanoparticles for photothermal therapy of diabetic wound infection in vivo[J]. Chemistry Select, 2018, 3(32): 9510-9516. |
| [10] |
GUO W, GUO C, ZHENG N, et al. CsxWO3 nanorods coated with polyelectrolyte multilayers as a multifunctional nanomaterial for bimodal imaging-guided photothermal/photodynamic cancer treatment[J]. Advanced Materials, 2016, 29(4): 1604157. |
| [11] |
HUANG X, ZHANG W, GUAN G, et al. Design and functionalization of the nir-responsive photothermal semiconductor nanomaterials for cancer theranostics[J]. Accounts of Chemical Research, 2017, 50(10): 2529-2538. DOI:10.1021/acs.accounts.7b00294 |
| [12] |
LI Y, LU W, HUANG Q, et al. Copper sulfide nanoparticles for photothermal ablation of tumor cells[J]. Nanomedicine, 2010, 5(8): 1161-1171. DOI:10.2217/nnm.10.85 |
| [13] |
TIAN Q W, TANG M H, SUN Y G, et al. Hydrophilic flower-like CuS superstructures as an efficient 980 nm laser-driven photothermal agent for ablation of cancer cells[J]. Advanced Materials, 2011, 23(31): 3542-3547. DOI:10.1002/adma.201101295 |
| [14] |
PRASANTH S, RITHESH RAJ D, VINEESHKUMAR T V, et al. Exploring the interaction of l-cysteine capped CuS nanoparticles with bovine serum albumin (BSA):a spectroscopic study[J]. RSC Advances, 2016, 6(63): 58288-58295. DOI:10.1039/C6RA03583C |
| [15] |
MOU J, LIU C, LI P, et al. A facile synthesis of versatile Cu2-xS nanoprobe for enhanced MRI and infrared thermal/photoacoustic multimodal imaging[J]. Biomaterials, 2015, 57: 12-21. DOI:10.1016/j.biomaterials.2015.04.020 |
| [16] |
ZHONG W, YU N, ZHANG L, et al. Synthesis of cus nanoplate-containing PDMS film with excellent near-infrared shielding properties[J]. RSC Advances, 2016, 6(23): 18881-18890. DOI:10.1039/C5RA22611B |
| [17] |
KUMARI A, YADAV S K, YADAV S C. Biodegradable polymeric nanoparticles based drug delivery systems[J]. Colloids and Surfaces:B, 2010, 75(1): 1-18. DOI:10.1016/j.colsurfb.2009.09.001 |
| [18] |
WEN J, YANG K, LIU F, et al. Diverse gatekeepers for mesoporous silica nanoparticle based drug delivery systems[J]. Chemical Society Reviews, 2017, 46(19): 6024-6045. DOI:10.1039/C7CS00219J |
| [19] |
WANG Y, WU Y, LIU Y, et al. BSA-mediated synthesis of bismuth sulfide nanotheranostic agents for tumor multimodal imaging and thermoradiotherapy[J]. Advanced Functional Materials, 2016, 26(29): 5335-5344. DOI:10.1002/adfm.201601341 |
| [20] |
ZHENG W, ZHENG Y F. Gelatin-functionalized carbon nanotubes for the bioelectrochemistry of hemoglobin[J]. Electrochemistry Communications, 2007, 9(7): 1619-1623. DOI:10.1016/j.elecom.2007.03.007 |
| [21] |
LIU K, ZHANG J J, CHENG F F, et al. Green and facile synthesis of highly biocompatible graphene nanosheets and its application for cellular imaging and drug delivery[J]. Journal of Materials Chemistry, 2011, 21(32): 12034-12040. DOI:10.1039/c1jm10749f |
| [22] |
MUYONGA J H, COLE C G B, DUODU K G. Fourier transform infrared spectroscopic study of acid soluble collagen and gelatin from skins and bones of young and adult nile perch[J]. Food Chemistry, 2004, 86(3): 325-332. DOI:10.1016/j.foodchem.2003.09.038 |
| [23] |
ROPER D K, AHN W, HOEPFNER M. Microscale heat transfer transduced by surface plasmon resonant gold nanoparticles[J]. The Journal of Physical Chemistry:C, 2007, 111(9): 3636-3641. DOI:10.1021/jp064341w |
 2020, Vol. 48
2020, Vol. 48


