文章信息
- 候冰娜, 郑泽邻, 赵梓年, 李进, 倪凯, 赵琳琳, 李征征
- HOU Bing-na, ZHENG Ze-lin, ZHAO Zi-nian, LI Jin, NI Kai, ZHAO Lin-lin, LI Zheng-zheng
- 可注射海藻酸钠/泊洛沙姆复合水凝胶的制备及药物缓释研究
- Preparation of injectable sodium alginate/ poloxamer composite hydrogel for sustained drug release
- 材料工程, 2020, 48(12): 60-67
- Journal of Materials Engineering, 2020, 48(12): 60-67.
- http://dx.doi.org/10.11868/j.issn.1001-4381.2020.000283
-
文章历史
- 收稿日期: 2020-03-30
- 修订日期: 2020-07-01
2. 南京霖厚环保科技有限公司, 南京 210001;
3. 天津理工大学 材料科学与工程学院, 天津 300457;
4. 天津科技大学 天津市制浆造纸重点实验室, 天津 300457;
5. 复旦大学 聚合物分子工程国家重点实验室, 上海 200433
2. Nanjing Linhou Environmental Protection Technology Co., Ltd., Nanjing 210001, China;
3. School of Materials Science and Engineering, Tianjin University of Technology, Tianjin 300457, China;
4. Tianjin Key Laboratory of Pulp and Paper, Tianjin University of Science and Technology, Tianjin 300457, China;
5. State Key Laboratory of Molecular Engineering of Polymers, Fudan University, Shanghai 200433, China
水凝胶是一种以共价键或非共价键交联而形成的具有三维网络结构的高分子材料,能够吸收并保存大量水分,在生物医药等领域有广泛的应用前景[1-3]。温敏性水凝胶是一类具有温度依赖性的水凝胶,在近年来其作为一种性能优良的可注射型生物材料而备受关注[4-6]。温敏性水凝胶在低温时呈溶液状态,当温度接近相转变温度时,溶液转变为凝胶状态,因此可以作为药物载体实现局部给药,广泛应用于药物载体及生物组织工程等领域[7-9]。
泊洛沙姆是由聚(环氧乙烷)和聚(环氧丙烷)组成的三嵌段共聚物,是一种温敏性合成聚合物,通常用来制备可注射水凝胶[10-11]。泊洛沙姆通过聚合物内环氧乙烷和环氧丙烷间的亲疏水相互作用,能够在高于其临界溶液温度时形成水凝胶[12]。因此,随着温度改变,泊洛沙姆溶液表现出溶胶-凝胶可逆转变[13]。基于泊洛沙姆的溶胶-凝胶转变性质,泊洛沙姆能够作为药物载体,用于治疗烧伤和经皮给药等领域[14-16]。泊洛沙姆由于相对分子质量低,制备的水凝胶机械强度低,凝胶响应温度宽,限制了其在生物医药领域的应用[17]。
海藻酸钠(SA)是一种从褐藻中提取的天然高分子材料,是由β-D-甘露糖醛酸和α-L-古洛糖醛酸按照(1→4)糖苷键连接而成的线型聚合物[18]。海藻酸钠具有良好的生物相容性、亲水性和生物降解性,已被用于伤口敷料、关节软骨修复和药物缓释等方面[19-21]。海藻酸钠能够在极其温和的条件下快速形成凝胶[22],本研究为降低泊洛沙姆温敏水凝胶的溶胶-凝胶转变浓度,以泊洛沙姆(P407)为基体,通过加入海藻酸钠制备海藻酸钠/泊洛沙姆温敏性复合水凝胶(SA/P407),研究不同质量比(0.5:1,0.6:1,0.8:1,1.0:1)对SA/P407复合水凝胶性能的影响。通过傅里叶红外光谱(FT-IR)、试管倒置法、扫描电子显微镜(SEM)和旋转流变仪分别对SA/P407复合水凝胶的结构、温敏性、微观形貌和动态黏弹性进行表征,考察了SA/P407复合水凝胶的质量比对其溶胶-凝胶转变温度和溶胀性能的影响。采用紫外-可见分光光度计(UV-Vis),研究了SA/P407复合水凝胶对药物吉西他滨的体外药物释放性能的影响。
1 实验材料与方法 1.1 试剂海藻酸钠,广州化学试剂厂,分析纯;泊洛沙姆407,德国巴斯夫有限公司,分析纯;吉西他滨,纯度>99%,购于上海阿拉丁生物科技有限公司。
1.2 实验过程称取一定质量比(0.5:1,0.6:1,0.8:1,1.0:1)的海藻酸钠和泊洛沙姆于血清瓶中,加入1 mL去离子水,用漩涡振荡器振荡5~10 min,在4 ℃下溶解24 h,制得SA/P407温敏性复合水凝胶样品。
1.3 测试与性能表征通过MAGNA560型傅里叶红外光谱仪对SA/P407复合水凝胶样品进行红外光谱测定,将SA/P407复合水凝胶冷冻干燥,然后用KBr压片,波数范围为500~4000 cm-1,扫描32次,分辨率为4 cm-1。通过JSM-7000F型场致扫描电子显微镜观察SA/P407复合水凝胶样品的微观结构,SA/P407复合水凝胶冷冻干燥后在液氮中淬冷30 s,制成切片,进行喷金处理,喷金时间为5 min。
采用试管倒置法,测定SA/P407复合水凝胶的溶胶-凝胶转变温度。在4 ℃下,将海藻酸钠和泊洛沙姆溶于磷酸盐缓冲溶液中,在5 mL的试管中配制成不同质量比(0.5:1,0.6:1,0.8:1,1.0:1)的溶液。试管放入升温装置内(升温速率为0.2 ℃/min),每过一段时间,将试管倒置,观察试管中溶液的流动情况。若试管倒置30 s,管内物质不发生流动,则确定此温度为溶胶-凝胶转变温度。
通过RS6000旋转流变仪测试SA/P407复合水凝胶的动态黏弹性。将厚度为1.0 mm的水凝胶样品置于行板之间,调节板间距为1.0 mm。测定储能模量(G′)和损耗模量(G″)随时间(0~1000 s)的变化关系,测试温度为37 ℃;测定G′和G″随温度(5~50 ℃)的变化关系,测试条件为频率1 Hz,应变0.1%,G′与G″曲线的交点所对应的温度即为SA/P407复合水凝胶的溶胶-凝胶转变温度。
称取一定量的SA/P407复合干凝胶,在37 ℃下浸入磷酸盐缓冲溶液中,一段时间后取出水凝胶,用滤纸吸去表明多余的磷酸盐缓冲溶液后称重。所有实验进行三次取其平均值。溶胀比(Sw)由水凝胶质量(mwet)与干凝胶质量(mdry)确定,可通过式(1)计算:
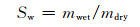
|
(1) |
通过Mini-1024型紫外-可见分光光度计(UV-Vis)测试SA/P407复合水凝胶对抗癌药物吉西他滨的体外药物释放性能。在4 ℃下,将SA/P407和吉西他滨溶于PBS溶液中。在5 mL的试管中配制1 mL的SA/P407溶液,吉西他滨的最终浓度为10 mg/mL,在37 ℃下放置30 min,制得SA/P407载药凝胶。向每个试管中的载药凝胶顶部缓慢滴加3 mL PBS,置于37 ℃的恒温水浴摇床中(振荡速度为20 r/min),一定时间后,将3 mL PBS移除,同时加入等体积的新鲜PBS来补偿释放介质。通过Mini-1024型紫外-可见分光光度计测定释放介质在波长268 nm的吸光度来确定药物浓度,绘制药物释放曲线。累积药物释放率Ar可通过式(2)[23]计算:

|
(2) |
式中:V0是释放介质的总体积;ct是在某个时间点测量的PBS中吉西他滨的浓度;V是每次所取PBS的体积;t为测试药物释放次数;c为每次取PBS的浓度;b为表征释放机制的释放指数;m是SA/P407复合水凝胶的载药量。
2 结果与分析 2.1 SA/P407复合水凝胶的制备与表征以泊洛沙姆为基体,固定P407浓度为6%(质量分数,下同),分别加入不同质量的海藻酸钠制备SA/P407复合水凝胶,配方如表 1。随着海藻酸钠加入量的增加,SA/P407复合水凝胶的溶胶-凝胶转变温度逐渐降低。图 1为泊洛沙姆和不同质量比(0.5:1,0.6:1,0.8:1,1.0:1)的SA/P407复合水凝胶样品的红外光谱图。结果表明,与泊洛沙姆谱图相比,SA/P407复合水凝胶样品在1459 cm-1和1413 cm-1处分别出现C=O伸缩振动吸收峰和O—H变形振动吸收峰,说明成功制备了SA/P407复合水凝胶。
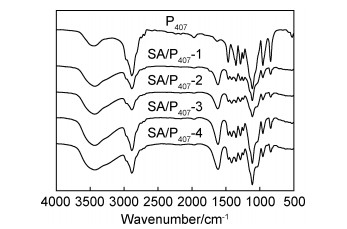
| Sample | Mass ratioa | Temperature/℃ |
| SA/P407-1 | 0.5:1 | 43.2 |
| SA/P407-2 | 0.6:1 | 36.4 |
| SA/P407-3 | 0.8:1 | 26.6 |
| SA/P407-4 | 1.0:1 | 25.7 |
| a Mass fraction of P407 is 6%. | ||
|
图 1 不同配比SA/P407复合水凝胶样品的红外光谱图 Fig. 1 FT-IR spectra of SA/P407 composite hydrogel with different ratios |
通过试管倒置法测定了不同配比的SA/P407复合水凝胶的溶胶-凝胶转变温度。图 2为SA/P407复合水凝胶的溶胶-凝胶转变温度随海藻酸钠/泊洛沙姆质量比的变化关系。浓度为6%的泊洛沙姆样品未出现溶胶-凝胶转变,在浓度为6%的泊洛沙姆溶液中加入一定质量比的海藻酸钠,SA/P407复合水凝胶出现溶胶-凝胶转变,溶胶-凝胶转变温度在25.7~43.2 ℃之间。SA/P407复合水凝胶(0.5:1,0.6:1,0.8:1,1.0:1)的凝胶化温度分别为43.2,36.4,26.6,25.7 ℃。结果表明,随着海藻酸钠与泊洛沙姆的质量比增加,SA/P407复合水凝胶的溶胶-凝胶转变温度降低。海藻酸钠加入量的增多,使海藻酸钠与泊洛沙姆之间的氢键相互作用增强,因此SA/P407复合水凝胶在较低温度下更容易成胶。通过控制海藻酸钠的加入量能够使SA/P407复合水凝胶的溶胶-凝胶转变温度控制在25~37 ℃之间,有利于其应用在药物缓释领域。此外,当温度由体温降至室温时,凝胶状的SA/P407复合水凝胶会转变为溶胶状态,说明SA/P407复合水凝胶的溶胶-凝胶转变行为具有热可逆性。泊洛沙姆P407在浓度为15%~30%时出现溶胶-凝胶转变,然而加入海藻酸钠的泊洛沙姆P407在浓度为6%时能够形成凝胶,表明海藻酸钠的加入降低了泊洛沙姆的成胶浓度。
|
图 2 SA/P407复合水凝胶的溶胶-凝胶转变相图 Fig. 2 Sol-gel transition phase diagram of SA/P407 composite hydrogel measured |
图 3为不同质量配比的SA/P407复合水凝胶的微观形态。SA/P407复合水凝胶具有高度孔隙化且孔隙之间相互连通的结构特点,孔径在20~80 μm范围内。SA/P407复合水凝胶的孔径大小随着海藻酸钠/泊洛沙姆质量比的增加逐渐缩小。随着海藻酸钠加入量的增多,SA/P407复合水凝胶的羧基和羟基增多,海藻酸钠与泊洛沙姆之间的氢键相互作用增强,从而使SA/P407复合水凝胶的交联密度增加,导致了孔径逐渐缩小。结果表明,通过控制海藻酸钠/泊洛沙姆的质量比能够实现对孔径的调节。SA/P407复合水凝胶的多孔结构使其在药物缓释载体及组织工程支架等方面具有潜在的应用价值。

|
图 3 配比为0.5:1(a),0.6:1(b),0.8:1(c)和1.0:1(d)的SA/P407复合水凝胶的SEM图像 Fig. 3 SEM images of SA/P407 composite hydrogels with ratios of 0.5:1(a), 0.6:1(b), 0.8:1(c) and 1.0:1(d) |
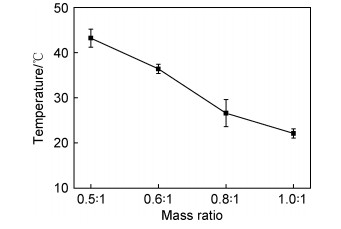
通过流变学研究确定SA/P407复合水凝胶的黏弹性与温度的关系。图 4显示了SA/P407复合水凝胶的G′和G″随温度的变化曲线。如图 4所示,不同质量比(0.5:1,0.6:1,0.8:1,1.0:1)的SA/P407复合水凝胶的溶胶-凝胶转变温度分别为43.2,36.4,26.6,25.7 ℃。在温度低于溶胶-凝胶转变温度时,G′低于G″,表明SA/P407复合水凝胶仍处于溶胶状态,没有发生溶胶-凝胶转变。随着温度升高,SA/P407复合水凝胶的G′迅速增加并高于G″,表明SA/P407复合水凝胶发生了溶胶-凝胶相变,G′与G″的交点即为溶胶-凝胶转变温度。海藻酸钠的加入增强了分子间相互作用力,因此,SA/P407复合水凝胶相比于泊洛沙姆水凝胶,能够在更低的浓度下表现出温敏性。随着海藻酸钠加入量的增加,SA/P407复合水凝胶的溶胶-凝胶转变温度逐渐降低。通过控制海藻酸钠的添加量能够控制SA/P407复合水凝胶的溶胶-凝胶转变温度,降低泊洛沙姆在体温下的溶胶-凝胶转变浓度。与其他温敏水凝胶体系相比,海藻酸钠和泊洛沙姆水凝胶体系不需要加入其他化学添加剂(如交联剂、盐等),更加温和安全,更适合应用在生物医学领域。

|
图 4 SA/P407复合水凝胶的温度依赖性流变行为 (a)SA/P407-1;(b)SA/P407-2;(c)SA/P407-3;(d)SA/P407-4 Fig. 4 Temperature dependent rheological behavior of SA/P407 composite hydrogel (a)SA/P407-1;(b)SA/P407-2;(c)SA/P407-3;(d)SA/P407-4 |
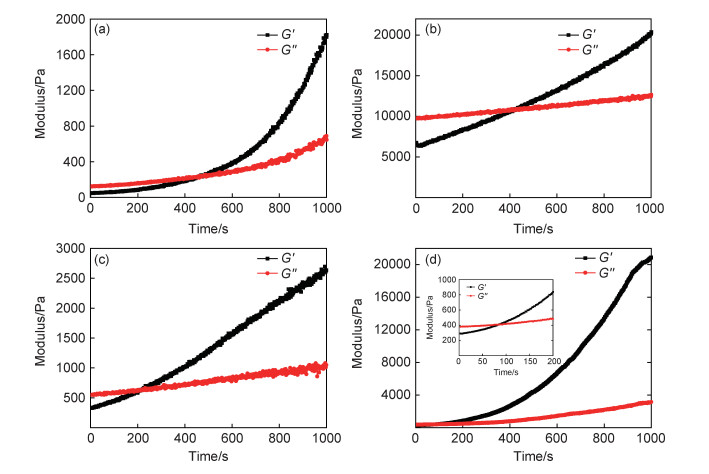
图 5为不同质量比(0.5:1,0.6:1,0.8:1,1.0:1)的SA/P407复合水凝胶在37 ℃下的时间依赖性流变行为,其凝胶化时间分别为476, 426, 218 s和84 s。随着海藻酸钠添加量的增加,SA/P407溶液在37 ℃下表现出更快的溶胶-凝胶转变。随着海藻酸钠的加入,SA/P407复合水凝胶的羧基和羟基增多,SA/P407复合水凝胶的分子间作用力增强,导致其溶胶-凝胶转变速度加快。
|
图 5 SA/P407复合水凝胶的时间依赖性流变行为 (a)SA/P407-1;(b)SA/P407-2;(c)SA/P407-3;(d)SA/P407-4 Fig. 5 Time dependent rheological behavior of SA/P407 composite hydrogel (a)SA/P407-1;(b)SA/P407-2;(c)SA/P407-3;(d)SA/P407-4 |
图 6显示了SA/P407复合水凝胶在37 ℃下溶胀行为随时间的变化曲线。不同质量比(0.5:1,0.6:1,0.8:1,1.0:1)的SA/P407复合水凝胶的最高溶胀率分别为4.8, 4.3, 4.1, 4.0。SA/P407复合水凝胶的溶胀率随海藻酸钠添加量的增加而降低。由于海藻酸钠的添加量增多,导致极性基团羧基和羟基增多,从而使分子间氢键等相互作用增强,水凝胶交联密度增高。结果表明,SA/P407复合水凝胶的交联密度越高,溶胀率越低。
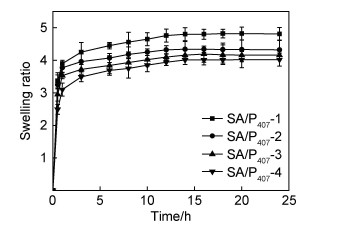
|
图 6 SA/P407复合水凝胶的溶胀性能 Fig. 6 Swelling properties of SA/P407 composite hydrogel |
SA/P407复合载药凝胶的累积药物释放率随时间的变化情况如图 7所示。由药物释放曲线可知,在释放初期,SA/P407复合载药凝胶出现吉西他滨快速释放的现象,在10 min内SA/P407-1, SA/P407-2, SA/P407-3和SA/P407-4水凝胶分别释放了20%, 15%, 10%和10%的吉西他滨。随着时间的延长,SA/P407复合载药凝胶内部的吉西他滨向外扩散释放,吉西他滨的浓度梯度逐渐降低,释放速率逐渐减缓,在24 h内SA/P407-1, SA/P407-2, SA/P407-3和SA/P407-4水凝胶分别累积释放了82%, 76%, 70%和66%的吉西他滨。在24 h后,吉西他滨的释放速率变得非常缓慢甚至趋近于零,在24~72 h内仅释放了12%, 13%, 10%和8%的吉西他滨。在72 h后吉西他滨的释放速率趋近于零,表明SA/P407复合水凝胶的吉西他滨释放达到了平衡,此时SA/P407水凝胶的药物释放率分别为94%, 89%, 80%及74%。SA/P407载药凝胶的药物释放是由吉西他滨在水凝胶内外的浓度差和渗透压差引起的,浓度差和渗透压差驱使吉西他滨通过水凝胶孔洞中的水向外扩散[24-25]。此外,SA/P407复合水凝胶的交联度也会影响吉西他滨的释放,交联度升高会使SA/P407复合水凝胶网络变得紧密,阻碍SA/P407复合水凝胶内分子链段的运动与松弛,从而使SA/P407复合水凝胶内部溶解吉西他滨的水分子较难向外扩散,限制吉西他滨的释放[26-27],因此SA/P407载药凝胶的吉西他滨释放率随交联度的增大而降低。SA/P407复合水凝胶的吉西他滨释放时间可达72 h,表明SA/P407复合水凝胶对吉西他滨具有缓释作用,有望成为一种新型抗癌药物载体。
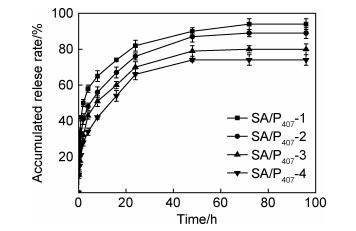
|
图 7 SA/P407复合水凝胶的体外药物释放性能 Fig. 7 In vitro release profiles of SA/P407 composite hydrogel |
(1) 以泊洛沙姆为基体,通过与海藻酸钠混合制备了温敏性SA/P407复合水凝胶,SA/P407复合水凝胶具有高度孔隙化且孔隙之间相互连通的结构特点,其孔径大小在20~80 μm范围内。
(2) SA/P407复合水凝胶的溶胶-凝胶转变温度能够控制在室温与体温(25~37 ℃)之间。通过加入海藻酸钠,降低了泊洛沙姆在体温下的成胶浓度(6%),缩短了SA/P407复合水凝胶的凝胶化时间(84 s)。
(3) SA/P407复合水凝胶的溶胀率随海藻酸钠添加量的增加而逐渐降低。
(4) SA/P407复合水凝胶对抗癌药物吉西他滨具有缓释作用,药物释放时间可达72 h。基于以上结论,SA/P407复合水凝胶在可注射药物缓释载体方面具有良好的应用前景。
| [1] |
薛诗山, 武元鹏, 刘兰芳, 等. 基于金属离子交联的自修复聚丙烯酸水凝胶[J]. 高分子材料科学与工程, 2018, 34(7): 20-24. XUE S S, WU Y P, LIU L F, et al. Self-healing poly (acrylic acid) hydrogels based on crosslinking of metallic ion[J]. Polymer Materials Science and Engineering, 2018, 34(7): 20-24. |
| [2] |
ASHRAF S, PARK H K, PARK H, et al. Snapshot of phase transition in thermoresponsive hydrogel PNIPAM: role in drug delivery and tissue engineering[J]. Macromolecular Research, 2016, 24(4): 297-304. |
| [3] |
KIM K, BAE B, KANG Y J, et al. Natural polypeptide-based supramolecular nanogels for stable noncovalent encapsulation[J]. Biomacromolecules, 2013, 14(10): 3515-3522. DOI:10.1021/bm400846h |
| [4] |
VERMONDEN T, CENSI R, HENNINK W E. Hydrogels for protein delivery[J]. Chemical Reviews, 2012, 112(5): 2853-2888. |
| [5] |
KOPECEK J. Hydrogels: from soft contact lenses and implants to self-assembled nanomaterials[J]. Journal of Polymer Science: Part A, 2009, 47(22): 5929-5946. DOI:10.1002/pola.23607 |
| [6] |
DENG A, KANG X, ZHANG J. Enhanced gelation of chitosan/β-sodium glycerophosphate thermosensitive hydrogel with sodium bicarbonate and biocompatibility evaluated[J]. Materials Science and Engineering:C, 2017, 78: 1147-1154. DOI:10.1016/j.msec.2017.04.109 |
| [7] |
LEE P Y, LI Z, HUANG L. Thermosensitive hydrogel as a Tgf-β1 gene delivery vehicle enhances diabetic wound healing[J]. Pharmaceutical Research, 2004, 20(12): 1995-2000. |
| [8] |
QU Y, WANG B Y, CHU B, et al. Injectable and thermosensitive hydrogel and PDLLA electrospun nanofiber membrane composites for guided spinal fusion[J]. ACS Applied Materials and Interfaces, 2018, 10(5): 4462-4470. DOI:10.1021/acsami.7b17020 |
| [9] |
PATEL P, MANDAL A, GOTE V, et al. Thermosensitive hydrogel-based drug delivery system for sustained drug release[J]. Journal of Polymer Research, 2019, 26(6): 131-142. DOI:10.1007/s10965-019-1771-z |
| [10] |
JUNG Y S, PARK W, PARK H, et al. Thermo-sensitive injectable hydrogel based on the physical mixing of hyaluronic acid and Pluronic F-127 for sustained NSAID delivery[J]. Carbohydrate Polymers, 2016, 156: 403-408. |
| [11] |
XIONG X Y, TAM K C, GAN L H. Polymeric nanostructures for drug delivery applications based on pluronic copolymer systems[J]. Journal of Nanoscience and Nanotechnology, 2006, 6(9): 2638-2650. DOI:10.1166/jnn.2006.449 |
| [12] |
PARK K M, LEE S Y, JOUNG Y K, et al. Thermosensitive chitosan-pluronic hydrogel as an injectable cell delivery carrier for cartilage regeneration[J]. Acta Biomaterialia, 2009, 5(6): 1956-1965. DOI:10.1016/j.actbio.2009.01.040 |
| [13] |
JEONG B, KIM S W, BAE Y H. Thermosensitive sol-gel reversible hydrogels[J]. Advanced Drug Delivery Reviews, 2002, 54(1): 37-51. |
| [14] |
MAYOL L, QUAGLIA F, BORZACCHIELLO A, et al. A novel poloxamers/hyaluronic acid in situ forming hydrogel for drug delivery: rheological, mucoadhesive and in vitro release properties[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2008, 70(1): 199-206. DOI:10.1016/j.ejpb.2008.04.025 |
| [15] |
XU H L, XU J, SHEN B X, et al. Dual regulations of thermosensitive heparin-poloxamer hydrogel using ε-polylysine: bioadhesivity and controlled KGF release for enhancing wound healing of endometrial injury[J]. ACS Applied Materials and Interfaces, 2017, 9(35): 2950-29594. |
| [16] |
YU Y, FENG R, YU S. Nanostructured lipid carrier-based pH and temperature dual-responsive hydrogel composed of carboxymethyl chitosan and poloxamer for drug delivery[J]. International Journal of Biological Macromolecules, 2018, 114: 462-469. DOI:10.1016/j.ijbiomac.2018.03.117 |
| [17] |
高存帅, 刘萌萌, 毕可东, 等. 注射用泊洛沙姆407温敏型原位凝胶的研究进展[J]. 中国动物检疫, 2012, 29(5): 84-87. GAO C S, LIU M M, BI K D, et al. Recent advancement on poloxamer 407 thermosensitive in situ gel for injection[J]. China Journal of Animal Quarantine, 2012, 29(5): 84-87. |
| [18] |
MONTASER A S, REHAN M, EL-NAGAR M E. pH-thermosensitive hydrogel based on polyvinyl alcohol/sodium alginate/N-isopropyl acrylamide composite for treating re-infected wounds[J]. International Journal of Biological Macromolecules, 2018, 11: 252-275. |
| [19] |
LUO X B, MA M F, ZHOU X J. Hydroxyapatite-poly (vinyl alcohol)-sodium alginate porous hydrogels with poly (vinyl alcohol) surface layer used for articular cartilage repair[J]. Materials Science Forum, 2016, 852: 1155-1161. |
| [20] |
ABD EL-GHAFFAR M A, HASHEM M S, EL-AWADY M K, et al. pH-sensitive sodium alginate hydrogels for riboflavin controlled release[J]. Carbohydrate Polymers, 2012, 89(2): 667-675. |
| [21] |
SAARAI A, SEDLACEK T, KASPARKOVA V, et al. On the characterization of sodium alginate/gelatine-based hydrogels for wound dressing[J]. Journal of Applied Polymer Science, 2012, 126(Suppl 1): 79-88. |
| [22] |
高春梅, 柳明珠, 吕少瑜, 等. 海藻酸钠水凝胶的制备及其在药物释放中的应用[J]. 化学进展, 2013, 25(6): 1012-1022. GAO C M, LIU M Z, LU S Y, et al. Preparation of sodium alginate hydrogel and its application in drug release[J]. Progress in Chemistry, 2013, 25(6): 1012-1022. |
| [23] |
李征征, 徐子扬, 高留意, 等. 温敏性乙二醇壳聚糖水凝胶的制备及药物缓释性能[J]. 高等学校化学学报, 2016, 12(37): 2299-2305. LI Z Z, XU Z Y, GAO L Y, et al. Preparation and characterization of thermo-sensitive N-acetyl glycol chitosan hydrogel for sustained drug release[J]. Chemical Journal of Chinese Universities, 2016, 12(37): 2299-2305. |
| [24] |
DAS D, DAS R, GHOSH P, et al. Dextrin cross linked with poly (HEMA): a novel hydrogel for colon specific delivery of ornidazole[J]. RSC Advances, 2013, 3(47): 25340-25350. |
| [25] |
BACAITA S E, CIOBANU B C, POPA M, et al. Phases in temporal multiscale evolution of drug release mechanism from IPN-type chitosan based hydrogels[J]. Physical Chemistry Chemical Physics, 2014, 16(47): 25896-25905. |
| [26] |
WANG Y, WANG J, YUAN Z, et al. Chitosan cross-linked poly (acrylic acid) hydrogels: drug release control and mechanism[J]. Colloids and Surfaces: B, 2017, 152: 252-259. |
| [27] |
SINGH B, BALA R, CHAUHAN N. In vitro release dynamics of model drugs from psyllium and acrylic acid based hydrogels for the use in colon specific drug delivery[J]. Journal of Materials Science:Materials in Medicine, 2008, 19(8): 2771-2780. |
 2020, Vol. 48
2020, Vol. 48


