犬弓首蛔虫(Toxocara canis,T. canis)是一种寄生于犬及犬科动物胃肠道的寄生线虫,可通过摄入感染性虫卵或者感染性幼虫而感染。在终末宿主(如犬、狐狸和狼等)体内,感染性幼虫可穿过肠壁,通过静脉循环移行至肝和肺部,并最终在肠道中发育为成虫[1-2];在人及其他转续宿主体内,感染性幼虫无法正常发育成熟并且不断发生迁移,对宿主机体造成严重损害。人弓首蛔虫幼虫移行征包括眼睛幼虫移行症(ocular larva migrans,OLM)、内脏幼虫移行症(visceral larva migrans,VLM)、神经弓首蛔虫病(neurological toxocariasis,NT)、隐性弓首蛔虫病(covert toxocariasis,CT)等,表现为持续的嗜酸性粒细胞增多,视网膜炎、哮喘、癫痫、脑膜炎等症状,严重危害人类健康[3-5]。
C型凝集素(C-type lectins,C-TLs)是最早发现的动物凝集素之一,由110~130氨基酸基序组成,其中含有至少4~6个保守的半胱氨酸残基[6],由一个或多个双环结构的C型凝集素样结构域(C-type lectin like domain,CTLD)蛋白构成[7]。C-TLs通过该结构域识别并结合Ca2+依赖性碳水化合物,能与各种内源性和外源性C型凝集素样受体(C-type lectin receptor,CLR)相互作用,在调节宿主与病原体的相互作用及维持机体稳态中发挥着关键作用[8-9],同时也被证明可引起自身免疫性疾病和癌症[10]。寄生虫的C-TLs涉及多种生物学功能,如免疫逃避、清除凋亡小体和增强寄生虫的抗菌能力等[11-13]。据报道美洲钩虫(Necator americanus)分泌的C-TLs具有阻断钾离子通道的功能,使宿主发生局部免疫和神经功能失效[14];刚地弓形虫(Toxoplasma gondii)分泌的C-TLs通过与宿主体内CLR发生钙依赖性结合,促进其在细胞内和宿主细胞间的迁移,更易导致宿主发生全身感染[15];猪蛔虫(Ascaris suum)幼虫中C-TLs的大量表达可以逃避与宿主病原模式识别受体(pattern recognition receptor,PRR)的结合,从而利于自身的存活[16]。
目前,对于T. canis C-type lectins 4的研究较少。本研究拟运用分子生物学技术,首先克隆Tc-ctl-4全长基因并进行序列分析和多重序列比对,然后构建Tc-ctl-4/pCold TF原核表达载体并制备多克隆抗体;同时采用qRT-PCR和间接免疫荧光组织化学技术对Tc-ctl-4的表达情况及Tc-CTL-4的组织分布情况进行检测,为进一步研究Tc-CTL-4的生物学功能奠定基础。
1 材料与方法 1.1 材料T. canis采自西南大学荣昌校区动物医院的患病犬,鉴定后于液氮中保存;T. canis L2幼虫通过剖解T. canis雌虫子宫收集虫卵,置于PBS中,放置于恒温培养箱中培养1~2周获得;新西兰大白兔购自西南医科大学实验动物中心。
PremixTaq DNA聚合酶、pMD19-T(simple)Vector、限制性内切酶Xho Ⅰ、Hind Ⅲ以及TB GreenⓇPremix Ex TaqTM Ⅱ购自TaKaRa公司;琼脂糖凝胶DNA /PCR产物小量回收试剂盒、质粒提取试剂盒购自北京全式金生物技术有限公司;Protein A+G Agarose抗体纯化试剂盒购自碧云天生物技术公司;HRP标记的山羊抗兔IgG购自北京博奥生物技术有限公司。
1.2 方法1.2.1 引物的设计与合成 根据T. canis基因组数据(GenBank:AF126830.1),利用Primer-Premier 5.0对Tc-ctl-4和18S rRNA基因进行引物设计(表 1),引物送由重庆擎科生物科技有限公司合成。
|
|
表 1 本试验所使用引物信息 Table 1 Information of primers used in this study |
1.2.2 总RNA的提取与反转录 采用TRIzol法提取T. canis成虫的总RNA和T. canis雌、雄虫、L2幼虫及雌、雄虫各组织的RNA,用核酸蛋白测定仪检测其浓度和纯度;以提取的总RNA为模板,参照反转录试剂盒说明书反转录合成cDNA。
1.2.3 Tc-ctl-4全长基因克隆和序列分析 以T. canis的cDNA为模板进行PCR扩增,PCR反应条件:94 ℃预变性3 min、94 ℃变性30 s、56 ℃退火30 s、72 ℃延伸30 s,共35个循环,最后72 ℃延伸5 min;扩增产物经1%琼脂糖凝胶电泳,用凝胶成像系统扫描并记录结果。
按照北京全式金胶回收试剂盒说明回收PCR产物,按说明书将回收产物与pMD19-T(simple)Vector载体进行连接,将连接产物转化至100 μL DH5α感受态细胞中,并涂布于含IPTG和X-gal的LB/Amp+的琼脂平板中,于37 ℃恒温培养箱正置培养20~30 min后再倒置培养16 h。将菌液PCR鉴定为阳性的重组菌液送至重庆擎科生物科技有限公司测序。将测序后的序列利用Clustal Omega进行多重序列比对;使用SignalP 5.0 Server和SMART在线网站对Tc-CTL-4蛋白的信号肽和功能结构域进行预测;Tc-CTL-4蛋白的三维空间和功能预测则借助I-TASSER进行构建。
1.2.4 原核表达载体的构建 按质粒提取试剂盒说明提取阳性重组质粒Tc-ctl-4/pMD19-T和pCold TF质粒,经限制性内切酶Xho I和Hind Ⅲ双酶切,切胶回收目的基因Tc-ctl-4与pCold TF质粒,DNA Ligation Kit进行连接反应。在冰上配制连接反应液:Digested pCold TF DNA 1 μL,Tc-ctl-4 4 μL,Ligation Mix 5 μL;16 ℃反应1 h。重组表达质粒转化至DH5α感受态细胞,经蓝白斑筛选后,挑取白色单个菌落接种于LB/Amp+液体培养基中37 ℃ 180 r·min-1培养14~16 h。提取质粒,进行PCR、双酶切及测序鉴定。
1.2.5 目的蛋白的表达和纯化 挑选阳性菌,提取质粒,并将其转化至Escherichia coli BL21(DE3)感受态细胞,挑单菌落接种于LB/Amp+液体培养基,37 ℃ 180 r·min-1振荡培养6 h,OD600nm值约为0.8,加入0.6 mmol·L-1的IPTG 15 ℃诱导36 h;将菌液置于15 ℃,5 000 r·min-1离心10 min,收集菌体沉淀,生理盐水洗涤后使用Washing Buffer重悬菌体,并进行超声破碎,分别取破碎上清和破碎沉淀进行SDS-PAGE电泳检测;采用Ni-NTA纯化树脂预装柱纯化目的蛋白,利用SDS-PAGE电泳检测纯化的结果。
1.2.6 多克隆抗体的制备及鉴定 利用透析袋去除纯化蛋白中的咪唑,并采用冷冻真空干燥机浓缩蛋白。将250 μg重组蛋白与弗氏完全佐剂1∶1混合,乳化后对两只健康的新西兰大白兔进行颈背部多点皮下注射进行首免,同时采集免疫前兔血清做为阴性对照;每间隔2周,以200 μg重组蛋白与弗氏不完全佐剂1∶1混合,乳化后进行加强免疫;四次免疫后利用酶联免疫吸附试验检测血清中的效价,达到所需效价后采血制备、纯化多克隆抗体,采用SDS-PAGE电泳检测抗体纯化结果。以兔抗Tc-CTL-4多克隆抗体1∶5 000稀释作为一抗,并用HRP标记的羊抗兔IgG 1∶5 000稀释作为二抗,进行Western blot检测。
1.2.7 qRT-PCR 以T. canis雌、雄虫、L2幼虫及各组织(体壁、肠道及生殖组织等)的cDNA为模板,分别用设计好的Tc-ctl-4和18S rRNA荧光引物进行SYBR Green Ⅱ qRT-PCR扩增。采用2-ΔCt法对基因在T. canis雌、雄虫肠道、体壁和生殖组织中的相对表达量进行分析,每组3个重复。
1.2.8 HE染色 将T. canis雌、雄虫各3条浸泡在4%中性福尔马林中,经洗涤、梯度脱水、透明、浸蜡后进行组织包埋。用切片机对石蜡进行切片,在37 ℃水浴锅中展片,将石蜡片吸附在载玻片上,在70 ℃干燥箱中干燥4 h。
石蜡切片经二甲苯脱蜡、不同浓度酒精(100%、95%、85%和75%)梯度复水后,苏木素染色液处理10 min,蒸馏水水洗,1%盐酸酒精分色,蒸馏水蓝化5 min,伊红染液染色2~5 min,不同浓度酒精(75%、85%、95%和100%)脱水、二甲苯透明15 min、中性树胶封片,在光学显微镜(Olympus CX41)下观察虫体的组织学和形态学特征。
1.2.9 间接免疫荧光组化检测 石蜡切片经二甲苯脱蜡、不同浓度酒精(100%、95%、85%和75%)梯度复水后,枸橼酸钠进行抗原修复、ddH2O清洗2次、PBST清洗2次、封闭液室温封闭、结束后4 ℃过夜孵育一抗、37 ℃复温、PBST清洗2次、37 ℃避光孵育二抗1 h、PBST清洗2次、DAPI避光孵育5 min、PBST清洗2次后,在Olympus荧光成像显微镜(Tokyo, Japan)下检测荧光信号和观察虫体的组织学和形态学特征。
2 结果 2.1 Tc-ctl-4的组织差异表达以T. canis雌、雄虫及各组织和L2幼虫的cDNA为模板,使用18S rRNA引物作为内参基因,采用2-ΔCt法对T. canis雌、雄虫肠道、体壁和生殖道等各个组织中Tc-ctl-4基因的转录水平进行分析。qRT-PCR结果发现Tc-ctl-4基因在L2幼虫中检测到较高的转录水平,且极显著高于雌虫和雄虫的转录水平(图 1);在雌虫中子宫的转录水平最高,而雄虫中贮精囊的转录水平最高。

|
A. 雌、雄虫、L2幼虫Tc-ctl-4的组织差异表达;B. 雌虫Tc-ctl-4各组织差异表达;C. 雄虫Tc-ctl-4各组织差异表达。*.差异显著(P < 0.05),***、****.差异极显著(P < 0.01) A. Tissue differential expression of Tc-ctl-4 in female, male and L2 larvae; B. Differential expression of Tc-ctl-4 in female tissues; C. The differential expression of Tc-ctl-4 in male tissues. * means the difference was significant (P < 0.05), *** and **** means the difference was extremely significant (P < 0.01) 图 1 Tc-ctl-4的组织差异表达分析 Fig. 1 Tissue differential expression analysis of Tc-ctl-4 |
经PCR扩增,1%琼脂糖凝胶电泳结果显示,Tc-ctl-4在雌、雄虫和L2幼虫的全长CDS序列大小约为842 bp(图 2A)。将该序列克隆至pMD19-T(simple)载体,经菌液PCR鉴定,电泳结果显示,在842 bp处有特异性条带,阴性对照没有出现条带(图 2B)。
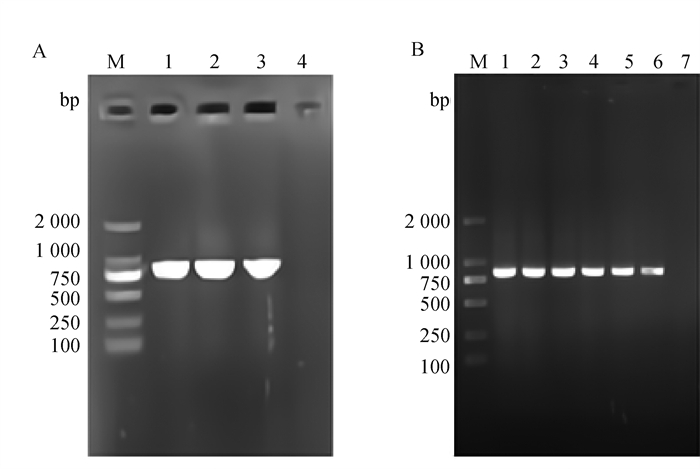
|
A. Tc-ctl-4的PCR扩增(1. T. canis雌虫;2. T. canis雄虫;3. L2幼虫;4.阴性对照);B. Tc-ctl-4/pMD19-T (simple)质粒检测(1~6为阳性质粒; 7为阴性对照);M. DNA相对分子质量标准 A. PCR amplification of Tc-ctl-4(1. T. canis female; 2. T. canis male; 3. L2 larvae; 4. Negative control); B. Tc-ctl-4/pMD19-T (simple)plasmid detection(1-6 were positive plasmids and 7 was negative control); M. DNA molecular weight marker 图 2 Tc-ctl-4基因扩增 Fig. 2 The PCR amplification of Tc-ctl-4 gene |
将阳性克隆的菌液送至公司测序,对获得的碱基序列进行分析。结果显示:Tc-ctl-4全长基因的序列长度为842 bp,含有1个完整的CDS,共编码280个氨基酸;功能结构域分析结果显示,Tc-CTL-4蛋白的1—18个氨基酸为信号肽,19—35位和84—100位为2个重复的Internal repeat 1(RPT)结构域以及152—280位为CTLD结构域(图 3)。
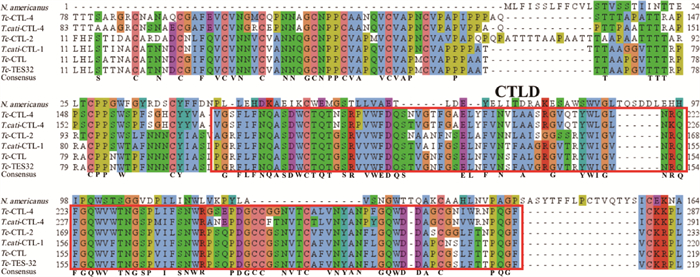
|
图 3 Tc-CTL-4蛋白氨基序列多重序列比对 Fig. 3 Multiple sequence alignment of amino sequence of Tc-CTL-4 protein |
将测序获得的Tc-CTL-4氨基酸序列与犬/猫弓首蛔虫的Tc-CTL(GenBank No. KU852582.1)、Tc-excretory/secretory C-type lectin TES-32(GenBank No. AF041023.1)、Tc-CTL-2(GenBank No. KR052876.1)、T.cati-CTL-1(GenBank No. MH183028.1)、T.cati-CTL-4(GenBank No. MH183027.1)以及美洲钩虫CTL-2(N. americanus;GenBank No.AF388311.1)的氨基酸序列进行多重序列比对。结果显示,犬弓首蛔虫和猫弓首蛔虫的C型凝集素均含有高度保守的CTLD结构域,该结构域有110个氨基酸,含有4个保守的半胱氨酸残基(图 3)。
2.4 Tc-CTL-4的空间结构及功能注释利用I-TASSER构建Tc-CTL-4蛋白的三维空间,其TM最高值为0.50ű0.15Å,标准差为10.2ű4.6Å(图 4A)。根据I-TASSER显示的空间结构及功能注释,发现Tc-CTL-4蛋白的结合位点为A269、D245、D267、D268和T214(图 4B)。酶活性位点为C161(图 4C)。基因本体论表明Tc-CTL-4蛋白的分子功能是结合碳水化合物(GO: 0030246)和C-乙酰转移酶活性(GO: 0016453);生物学过程为参与己糖代谢过程(GO: 0019318)、细胞黏附(GO: 0098609)和整个生物发育过程(GO: 0032502);细胞组分为细胞外所有区域组成(GO: 0044421)、细胞碎片(GO: 0000267)和细胞质(GO: 0005737)。
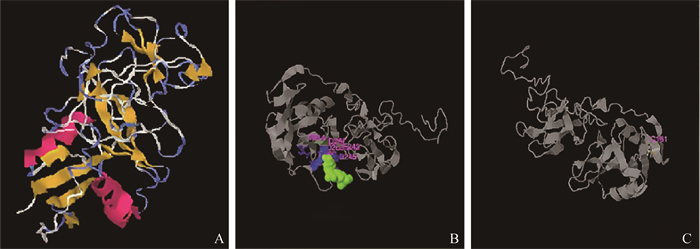
|
A.预测的蛋白模型;B.预测的残基结合位点;C.预测的活性位点 A. The model of the protein was deduced using I-TASSER; B. The predicted ligand binding site residues; C. The predicted active site residues 图 4 Tc-CTL-4的结构和功能预测 Fig. 4 Structure and function prediction of Tc-CTL-4 |
参照“1.2.3”对Tc-ctl-4基因进行克隆。对Tc-ctl-4/pMD19-T(simple)进行双酶切验证,电泳检测显示目的基因成功连接至pMD19-T(simple)载体(图 5A)。将测序成功的Tc-ctl-4序列亚克隆至pCold TF表达载体,经菌液PCR,1%琼脂凝胶电泳结果可见清晰明亮条带,且大小与预期相符(图 5B),表明成功构建了Tc-ctl-4/pCold TF原核表达载体,经双酶切鉴定,结果显示已成功连接至pCold TF表达载体(图 5C)。
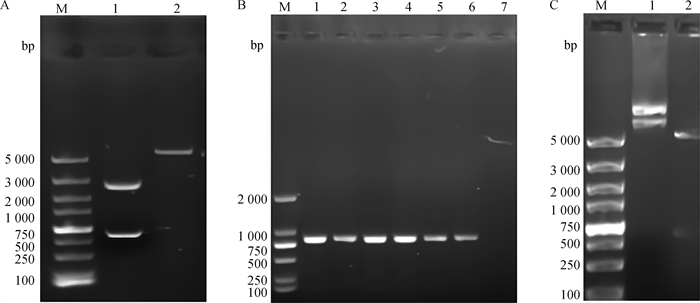
|
A. 双酶切Tc-ctl-4/pMD19-T(simple)质粒(1.双酶切Tc-ctl-4/pMD19-T(simple)质粒;2.双酶切pMD19-T(simple)空质粒);B. 重组Tc-ctl-4/pCold TF质粒PCR检测(1~6.重组Tc-ctl-4/pCold TF质粒;7.阴性对照);C. 双酶切重组Tc-ctl-4/pCold TF质粒(1. 重组Tc-ctl-4/pCold TF质粒;2. 双酶切鉴定重组Tc-ctl-4/pCold TF质粒);M. DNA相对分子质量标准 A. Double enzyme digestion of Tc-ctl-4/pMD19-T (simple) plasmid(1. The double enzyme digestion of Tc-ctl-4/pMD19-T(simple)plasmid; 2. The double enzyme digestion of pMD19-T (simple) empty plasmid); B. PCR detection of recombinant Tc-ctl-4/pCold TF plasmid (1-6 were positive plasmids and 7 was negative control); C. The recombinant Tc-ctl-4/pCold TF plasmid was digested by double enzymes(1. Recombinant Tc-ctl-4/pCold TF plasmids; 2. Identification of recombinant Tc-ctl-4/pCold TF plasmid by double enzymes); M. DNA molecular weight marker 图 5 Tc-ctl-4/pCold TF表达质粒的构建 Fig. 5 Construction of Tc-ctl-4/pCold TF expression plasmid |
将阳性重组质粒转化至BL21(DE3)感受态细胞后,经IPTG体外诱导表达,产物大部分以可溶性蛋白的形式存在,少量形成包涵体;重组蛋白Tc-CTL-4大小约为86 ku;利用Ni-NTA对重组蛋白进行纯化,纯化后的蛋白经SDS-PAGE检测无杂带,蛋白具有较高的浓度和纯度(图 6B)。
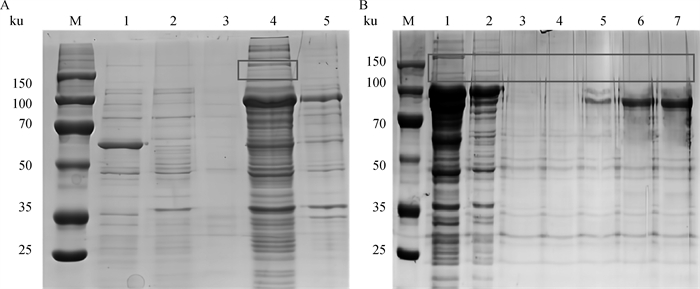
|
A.Tc-CTL-4的表达形式(M.蛋白质相对分子质量标准;1. 空载体pCold TF;2. Tc-ctl-4/pCold TF未诱导菌液;3. Tc-ctl-4/pCold TF菌液上清;4. 超声破碎后上清;5. 超声破碎后沉淀) B. Tc-CTL-4的纯化(M. 蛋白质相对分子质量标准;1. Tc-ctl-4/pCold TF重组蛋白过柱前;2. Tc-ctl-4/pCold TF重组蛋白过柱后;3~7. 20、50、100、250、500 mmol·L-1咪唑洗脱) A. Expression form of Tc-CTL-4(M. Protein molecular weight marker; 1. Empty vector pCold TF; 2. Uninduced bacterial solution of Tc-ctl-4/pCold TF; 3. Supernatant of Tc-ctl-4/pCold TF bacterial solution; 4. Supernatant after ultrasonic crushing; 5. Precipitation after ultrasonic crushing); B. Purification of Tc-CTL-4(M. Protein molecular weight marker; 1. Supernatant of Tc-ctl-4/pCold TF before passing through nickel column; 2. Supernatant of Tc-ctl-4/pCold TF after passing through nickel column; 3-7. 20, 50, 100, 250, 500 mmol·L-1 imidazole elution) 图 6 Tc-CTL-4重组蛋白的表达形式及纯化 Fig. 6 Expression form and purification of Tc-CTL-4 recombinant protein |
将纯化后的重组蛋白Tc-CTL-4包被96孔板,利用间接ELISA法测定兔抗Tc-CTL-4多克隆抗体的效价,结果显示,其抗体滴度>1∶160 000,具有较高的效价;Western blot检测结果显示兔抗Tc-CTL-4多克隆抗体纯度高于95%,5 000倍稀释后与重组Tc-CTL-4蛋白特异性结合,表明其特异性好(图 7B)。
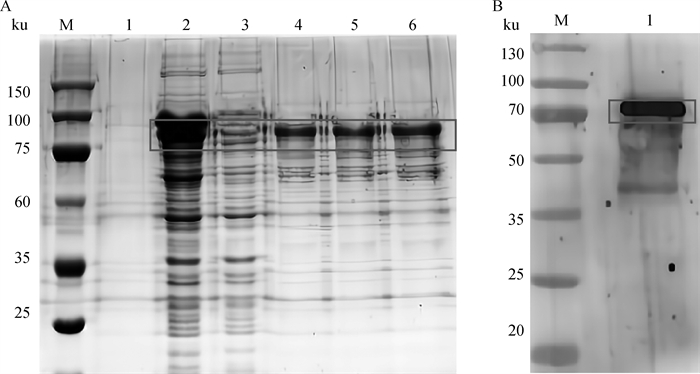
|
A. Tc-CTL-4蛋白的纯化(M.蛋白质相对分子质量标准;1. Tc-ctl-4/pCold TF未诱导菌液;2. Tc-ctl-4/pCold TF蛋白过柱前;3. 0 mmol·L-1咪唑;4~6. 500 mmol·L-1咪唑洗脱);B. 多克隆抗体特异性检测 A. Purification of Tc-CTL-4 protein(M. Protein molecular weight marker; 1. Uninduced bacterial solution of Tc-ctl-4/pCold TF; 2. Supernatant of Tc-ctl-4/pCold TF before passing through nickel column; 3. 0 mm·L-1imidazole; 4-6. 500 mmol·L-1 imidazole elution); B. Specific detection of polyclonal antibody 图 7 重组Tc-CTL-4蛋白的纯化及多克隆抗体特异性 Fig. 7 Purification of recombinant Tc-CTL-4 protein and specificity of polyclonal antibody |
采用间接免疫荧光组织化学方法,对Tc-CTL-4在T. canis雌、雄虫中的分布情况进行了研究。荧光结果显示,Tc-CTL-4主要分布在T. canis的生殖组织和体壁中(图 8绿色荧光显示部分);在雌虫体内,Tc-CTL-4主要分布在子宫、输卵管和体壁(图 8 Female A和B),其中,子宫中的绿色荧光信号最强烈,而体壁中的荧光较淡;在雄虫体内Tc-CTL-4主要分布在输精管和体壁中(图 8 Male)。对照组中未见荧光信号。
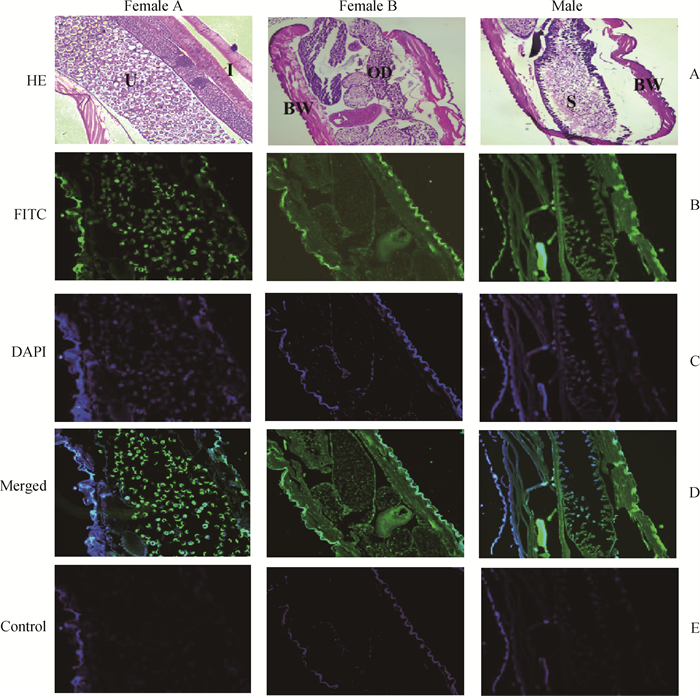
|
BW.体壁;I.肠道;U.子宫;OD.输卵管S.输精管. A. T. canis雌、雄切片HE染色;B. FITC标记的羊抗兔IgG抗体呈现Tc-CTL-4位置,显示绿色荧光;C. 细胞核染色,显示蓝色荧光;D. 蓝色、绿色荧光融合显示Tc-CTL-4位置;E. 免疫前血清对照 BW. Body wall; I. Intestine; U. Uterus; OD. Oviduct; S. Vas deferns. A. T. canis, female and male sections by HE staining; B. FITC labeled Goat anti rabbit IgG antibody showed Tc-ctl-4 position and showed green fluorescence; C. Nuclear staining, showing blue fluorescence; D. Blue and green fluorescence fusion showed the location of Tc-CTL-4; E. Preimmunization serum control 图 8 Tc-CTL-4在T. canis雌、雄虫组织中的免疫荧光组织化学定位 Fig. 8 Immunofluorescence histochemical localisation of Tc-CTL-4 in the tissues of adult male and female T. canis |
C-TLs是一类在生物体内大量表达的钙依赖性糖蛋白家族,其包含一个或多个CTLD,该结构域有一个特征性的双环,由两个高度保守的二硫键连接,有4个Ca2+结合位点。其不仅可以通过Ca2+结合位点与单糖或者寡糖发生结合,还可与碳水化合物结合;同时也可特征性识别病原体并通过蛋白质-碳水化合物相互作用而干扰内环境稳态和引发不同类型的免疫反应。Zimara等[17]发现小鼠在抗利什曼(Leishmania major)原虫免疫中,虫体分泌的C-TLs通过与小鼠Dectin-1结合引发宿主Th1型免疫反应,说明C-TLs与CLR结合所介导的信号传导参与了针对病原体的适应性免疫。C-TLs不仅在宿主免疫防御感染方面发挥重要作用,还在胚胎受精方面也发挥着关键作用。Rodeheffer和Shur[18]发现C-TLs在哺乳动物体内中通过识别卵子表面糖蛋白上的特定碳水化合物参与了胚胎受精。
犬弓首蛔虫共有4种C-TLs,即TES-32(Tc-CTL-1)、Tc-CTL-2、Tc-CTL-3和TES-70(Tc-CTL-4)[19-20]。其中,TES-32编码219个氨基酸,能结合甘露糖和半乳糖型单糖。Tc-CTL-2、3分别为TES-32的变体存在。TES-70是一种比TES-32更大的排泄分泌蛋白产物,是一种寄生虫凝集素的天然配体[21]。4种C-TLs均含有CTLD功能结构域,其功能涉及防御病原体、免疫调节和预防自身免疫。本试验的多重序列分析发现,除N.americanus-CTL-2外,Tc-CTL-4与犬/猫弓首蛔虫的C-TL序列均含有一个C末端钙依赖性CTLD结构域。该结构域可作为免疫系统的识别分子发挥作用,如树突状细胞相关凝集素1(dendritic cell-associated lectin 1,Dectin-1)和巨噬细胞诱导的Ca2+依赖性凝集素(macrophage-inducible Ca2+-dependent lectin,Mincle)与C-TLs结合后,通过脾酪氨酸激酶(spleen tyrosine kinase,Syk)磷酸化与配体结合发出信号,促进了CD4+T细胞的分化[22]。此外,Tc-CTL-4已经被证实为在发生寄生虫感染时具有免疫原性的一种重要蛋白质[23-24]。其与哺乳动物的髓样C型凝集素结构域的蛋白质受体(CLR)具有显著的同源性,表明其能与宿主体内的CLR结合,从而影响宿主的免疫反应[25]。
C型凝集素在寄生虫的发育、繁殖和先天免疫等过程中发挥了重要作用。Harcus等[26]在多形螺旋线虫(Heligmosomoides polygyrus)和巴西圆线虫(Nippostrongylus brasiliensis)的虫卵中检测到C-TLs的大量表达。Brown等[27]在斯里兰卡钩虫(Ancylostoma ceylanicum)雄虫的性腺和精子中也检测到C-TLs的大量表达。这些研究显示,C-TLs在线虫精卵识别和受精中具有潜在作用。本试验发现Tc-ctl-4基因在雌虫子宫的转录水平最高,在雄虫中贮精囊的转录水平最高,且雌虫生殖组织的转录水平远高于雄虫生殖组织的转录水平,表明C-TLs在犬弓首蛔虫的繁殖中具有重要作用。Mallo等[13]报道黏质沙雷菌(Serratia marcescens)感染秀丽隐杆线虫(C. elegans)后,在线虫肠道中检测到C-TLs的大量表达。而病原体入侵时肠道中的先天免疫系统发挥着至关重要的作用,表明C-TLs的高表达在线虫的先天免疫防御系统中起着关键作用。本试验在T. canis的肠道中也检测到Tc-ctl-4的转录,推测该基因可能在T. canis的先天免疫中具有一定的作用。此外,Tc-ctl-4基因在T. canis幼虫中也具有较高的转录水平。Etebar等[28]发现C-TLs是犬弓首蛔虫幼虫阶段分泌的糖蛋白之一,表明C-TLs在虫体的生长发育和免疫反应中发挥了重要作用。
本试验通过间接免疫组织化学方法进一步对Tc-CTL-4在T. canis雌、雄虫体内的分布情况进行检测,发现Tc-CTL-4主要分布在T. canis的生殖组织和体壁中。在雌虫体内,Tc-CTL-4主要分布在子宫、输卵管和体壁;在雄虫体内Tc-CTL-4主要分布在输精管和体壁。Brown等[27]利用间接免疫组化技术对A. ceylanicum进行研究,在雄虫的睾丸、雌虫的受精囊和发育的胚胎中均检测到C-TLs表达,表明其在线虫的精卵识别和受精过程中具有重要作用。Page等[29]通过免疫电子显微镜在犬弓首蛔虫体壁中检测到C-TLs的表达,说明C-TLs可作为一种表面抗原被释放到表皮之中。本试验也发现Tc-CTL-4存在于体壁中,推测其参与了宿主免疫反应,并在其中起着重要作用,但具体的作用机制有待后续进一步研究。
4 结论犬弓首蛔虫Tc-ctl-4基因的全长序列为842 bp,共编码280个氨基酸,原核表达得到可溶性重组蛋白Tc-CTL-4的大小约为86 ku。将纯化后的重组蛋白免疫新西兰大白兔制备多克隆抗体(抗体滴度>1∶160 000),Western blot结果显示,抗体能与Tc-CTL-4蛋白特异性结合,表明抗体特异性高。qRT-PCR结果显示,Tc-ctl-4基因在T. canis雌虫子宫和雄虫贮精囊的转录水平最高。间接免疫荧光试验结果显示Tc-CTL-4主要分布在T. canis生殖组织和体壁。以上结果表明,Tc-CTL-4在犬弓首蛔虫的繁殖和免疫中发挥了重要作用。
| [1] |
WU T, BOWMAN D D. Visceral larval migrans of Toxocara canis and Toxocara cati in non-canid and non-felid hosts[J]. Adv Parasitol, 2020, 109: 63-88. |
| [2] |
DOS SANTOS L M, DE MOURA M Q, AZEVEDO M L, et al. Reactivity of recombinant Toxocara canis TES-30/120 in experimentally infected mice[J]. Parasite Immunol, 2018, 40(8): e12568. DOI:10.1111/pim.12568 |
| [3] |
WU T K, BOWMAN D D. Toxocara canis[J]. Trends Parasitol, 2022, 38(8): 709-710. DOI:10.1016/j.pt.2022.01.002 |
| [4] |
WANGCHUK P, LAVERS O, WISHART D S, et al. Excretory/secretory metabolome of the zoonotic roundworm parasite Toxocara canis[J]. Biomolecules, 2020, 10(8): 1157. DOI:10.3390/biom10081157 |
| [5] |
LU C Y, LAI S C, LEE H H, et al. Matrix metalloproteinases activation in Toxocara canis induced pulmonary pathogenesis[J]. J Microbiol, Immunol, Infect, 2021, 54(6): 1147-1153. DOI:10.1016/j.jmii.2020.07.022 |
| [6] |
DRICKAMER K. C-type lectin-like domains[J]. Curr Opin Struct Biol, 1999, 9(5): 585-590. DOI:10.1016/S0959-440X(99)00009-3 |
| [7] |
ZELENSKY A N, GREADY J E. The C-type lectin-like domain superfamily[J]. FEBS J, 2005, 272(24): 6179-6217. DOI:10.1111/j.1742-4658.2005.05031.x |
| [8] |
WANG X W, VASTA G R, WANG J X. The functional relevance of shrimp C-type lectins in host-pathogen interactions[J]. Dev Comp Immunol, 2020, 109: 103708. DOI:10.1016/j.dci.2020.103708 |
| [9] |
MAYER S, RAULF M K, LEPENIES B. C-type lectins: their network and roles in pathogen recognition and immunity[J]. Histochem Cell Biol, 2017, 147(2): 223-237. DOI:10.1007/s00418-016-1523-7 |
| [10] |
LINDENWALD D L, LEPENIES B. C-type lectins in veterinary species: recent advancements and applications[J]. Int J Mol Sci, 2020, 21(14): 5122. DOI:10.3390/ijms21145122 |
| [11] |
LOUKAS A, MAIZELS R M. Helminth C-type lectins and host-parasite interactions[J]. Parasitol Today, 2000, 16(8): 333-339. DOI:10.1016/S0169-4758(00)01704-X |
| [12] |
NAGAE M, YAMAGUCHI Y. Structural aspects of carbohydrate recognition mechanisms of C-Type Lectins[M]//YAMASAKI S. C-Type Lectins in Immune Homeostasis. Cham: Springer, 2019, 429: 147-176.
|
| [13] |
MALLO G V, KURZ C L, COUILLAULT C, et al. Inducible antibacterial defense system in C. elegans[J]. Curr Biol, 2002, 12(14): 1209-1214. DOI:10.1016/S0960-9822(02)00928-4 |
| [14] |
DAUB J, LOUKAS A, PRITCHARD D I, et al. A survey of genes expressed in adults of the human hookworm, Necator americanus[J]. Parasitology, 2000, 120: 171-184. DOI:10.1017/S0031182099005375 |
| [15] |
NJIRI O A, ZHANG X Y, ZHANG Y M, et al. CD209 C-type Lectins promote host invasion, dissemination, and infection of Toxoplasma gondii[J]. Front Immunol, 2020, 11: 656. DOI:10.3389/fimmu.2020.00656 |
| [16] |
YOSHIDA A, NAGAYASU E, HORⅡ Y, et al. A novel C-type lectin identified by EST analysis in tissue migratory larvae of Ascaris suum[J]. Parasitol Res, 2012, 110(4): 1583-1586. DOI:10.1007/s00436-011-2677-9 |
| [17] |
ZIMARA N, CHANYALEW M, ASEFFA A, et al. Dectin-1 positive dendritic cells expand after infection with Leishmania major parasites and represent promising targets for vaccine development[J]. Front Immunol, 2018, 26: 263. |
| [18] |
RODEHEFFER C, SHUR B D. Characterization of a novel ZP3-independent sperm-binding ligand that facilitates sperm adhesion to the egg coat[J]. Development, 2004, 131(3): 503-512. DOI:10.1242/dev.00937 |
| [19] |
TETTEH K K A, LOUKAS A, TRIPP C, et al. Identification of abundantly expressed novel and conserved genes from the infective larval stage of Toxocara canis by an expressed sequence tag strategy[J]. Infect Immun, 1999, 67(9): 4771-4779. DOI:10.1128/IAI.67.9.4771-4779.1999 |
| [20] |
LOUKAS A, MULLIN N P, TETTEH K K A, et al. A novel C-type lectin secreted by a tissue-dwelling parasitic nematode[J]. Curr Biol, 1999, 9(15): 825-828. DOI:10.1016/S0960-9822(99)80366-2 |
| [21] |
LOUKAS A, DOEDENS A, HINTZ M, et al. Identification of a new C-type lectin, TES-70, secreted by infective larvae of Toxocara canis, which binds to host ligands[J]. Parasitology, 2000, 121(5): 545-554. DOI:10.1017/S0031182099006721 |
| [22] |
OSTROP J, LANG R. Contact, collaboration, and conflict: signal integration of Syk-coupled C-type lectin receptors[J]. J Immunol, 2017, 198(4): 1403-1414. DOI:10.4049/jimmunol.1601665 |
| [23] |
WEIS W I, DRICKAMER K, HENDRICKSON W A. Structure of a C-type mannose-binding protein complexed with an oligosaccharide[J]. Nature, 1992, 360(6400): 127-134. DOI:10.1038/360127a0 |
| [24] |
KOLATKAR A R, WEIS W I. Structural basis of galactose recognition by C-type animal lectins[J]. J Biol Chem, 1996, 271(12): 6679-6685. DOI:10.1074/jbc.271.12.6679 |
| [25] |
RAULF M K, LEPENIES B, STRUBE C. Toxocara canis and Toxocara cati somatic and excretory-secretory antigens are recognised by C-Type Lectin receptors[J]. Pathogens, 2021, 10(3): 321. DOI:10.3390/pathogens10030321 |
| [26] |
HARCUS Y, NICOLL G, MURRAY J, et al. C-type lectins from the nematode parasites Heligmosomoides polygyrus and Nippostrongylus brasiliensis[J]. Parasitol Int, 2009, 58(4): 461-470. DOI:10.1016/j.parint.2009.08.011 |
| [27] |
BROWN A C, HARRISON L M, KAPULKIN W, et al. Molecular cloning and characterization of a C-type lectin from Ancylostoma ceylanicum: evidence for a role in hookworm reproductive physiology[J]. Mol Biochem Parasitol, 2007, 151(2): 141-147. DOI:10.1016/j.molbiopara.2006.10.017 |
| [28] |
ETEBAR F, HOSSEINI S H, JALOUSIAN F, et al. Phylogenetic analysis of C type lectin from Toxocara canis infective larvae and comparison with the C type lectin family in the immune system of mouse and human[J]. Iran J Parasitol, 2018, 13(1): 49-57. |
| [29] |
PAGE A P, HAMILTON A J, MAIZELS R M. Toxocara canis: monoclonal antibodies to carbohydrate epitopes of secreted (TES) antigens localize to different secretion-related structures in infective larvae[J]. Exp Parasitol, 1992, 75(1): 56-71. DOI:10.1016/0014-4894(92)90122-Q |
(编辑 白永平)



